PROPIONATE DE FLUTICASONE/SALMETEROL ARROW
PRODUCTS Pulmonary PROPIONATE DE FLUTICASONE/SALMETEROL ARROWPROPIONATE DE FLUTICASONE/SALMETEROL ARROW
Dosage: 100 microgrammes/ 50 microgrammes/dose,500 microgrammes/ 50 microgrammes/dose

Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Indications thérapeutiques
Classe pharmacothérapeutique : adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques - code ATC : R03AK06.
· le salmétérol est un bêta-2 mimétique bronchodilatateur de longue durée d’action. Les bronchodilatateurs aident à garder les bronches ouvertes. Cela permet de faciliter l’entrée et la sortie de l’air dans les poumons. L’effet dure au moins 12 heures.
· le propionate de fluticasone est un corticoïde qui diminue l’inflammation et l’irritation dans les poumons.
Votre médecin vous a prescrit ce médicament pour aider à prévenir certains troubles respiratoires tels que l’asthme.
Vous devez utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER tous les jours comme indiqué par votre médecin. Cela permettra de contrôler correctement votre asthme.
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER permet d’éviter la survenue d’essoufflement et de sifflement. Cependant, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ne doit pas être utilisé lorsque vous avez une crise soudaine d’essoufflement ou de sifflement. Dans ces cas, vous devez utiliser votre médicament bronchodilatateur dit « de secours » d’action rapide et de courte durée, comme le salbutamol. Vous devez toujours avoir sur vous votre inhalateur dit « de secours » d’action rapide et de courte durée.
Groupe(s) générique(s)
Ce médicament n'appartient à aucun groupe générique
Composition en substances actives
-
 Poudre (Composition pour une dose mesurée)
Poudre (Composition pour une dose mesurée)
-
> propionate de fluticasone
 100 microgrammes
100 microgrammes
-
> salmétérol
 50 microgrammes
50 microgrammes
-
 sous forme de : xinafoate de salmétérol
sous forme de : xinafoate de salmétérol
-
-
> propionate de fluticasone
Présentations
> Dispositif plastique de 60 récipients unidoses
Code CIP : 34009 302 227 5 1Déclaration de commercialisation : 25/05/2022
Cette présentation est agréée aux collectivités
Taux de remboursement : 65 %
Service médical rendu (SMR) 
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Modéré | Avis du 05/01/2022 | Inscription (CT) | Le service médical rendu par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 500µg/50µg/dose est modéré dans la BPCO. |
Amélioration du service médical rendu (ASMR) 
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 05/01/2022 | Inscription (CT) | Ces spécialités sont des hybrides qui n’apportent pas d’amélioration du service médical rendu (ASMR V) par rapport à SERETIDE DISKUS. |
Autres informations (cliquer pour afficher)
- Titulaire de l'autorisation : ARROW GENERIQUES
- Conditions de prescription et de délivrance :
- Statut de l'autorisation : Valide
- Type de procédure : Procédure de reconnaissance mutuelle
- Code CIS : 6 504 346 9
ANSM - Mis à jour le : 08/03/2022
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Salmétérol............................................................................................................ 50 microgrammes
Sous forme de xinafoate de salmétérol
Pour une dose mesurée.
Soit
Propionate de fluticasone...................................................................................... 92 microgrammes
Salmétérol............................................................................................................ 47 microgrammes
Sous forme de xinafoate de salmétérol
Pour une dose délivrée à chaque inhalation au niveau de l’embout buccal.
Excipient à effet notoire :
Chaque dose délivrée contient environ 13 milligrammes de lactose (monohydraté).
Pour la liste complète des excipients, voir rubrique 6.1.
Poudre pour inhalation en récipient unidose.
Dispositif (distributeur) en plastique moulé contenant un film thermosoudé de 60 plaquettes régulièrement espacées. Chaque plaquette contient une dose pré-mesurée de poudre pour inhalation blanche à blanc cassé.
4.1. Indications thérapeutiques 
Asthme
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER est indiqué en traitement continu de l’asthme, dans les situations où l’administration par voie inhalée d’un médicament associant un corticoïde et un bronchodilatateur β2 agoniste de longue durée d’action est justifiée :
· chez des patients insuffisamment contrôlés par une corticothérapie inhalée et la prise d’un bronchodilatateur β2 agoniste de courte durée d’action par voie inhalée “à la demande”
ou
· chez des patients contrôlés par l’administration d’une corticothérapie inhalée associée à un traitement continu par β2 agoniste de longue durée d’action par voie inhalée.
Remarque : le dosage PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 µg/50 µg/dose n’est pas adapté au traitement de l’asthme sévère de l’adulte et de l’enfant.
4.2. Posologie et mode d'administration 
Il conviendra d’informer le patient que pour observer un effet optimal du traitement, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être administré quotidiennement, même en l’absence de symptômes.
Le médecin devra vérifier régulièrement que le dosage prescrit de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER est bien adapté à l’état clinique du patient. Il ne sera modifié que sur avis médical. Il convient de toujours rechercher la posologie minimale efficace. Lorsque les symptômes sont contrôlés par la plus faible posologie recommandée en deux prises par jour, l’administration d’un corticoïde inhalé seul sera alors envisagée. Il pourra être également envisagé de réduire la posologie de PROPIONATE DE FLUTICASONE/ SALMETEROL ARROW AIRMASTER à une prise par jour, si le médecin estime nécessaire de maintenir un traitement par β2 mimétique de longue durée d’action pour le contrôle des symptômes. L’horaire de la prise de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sera alors fonction de la fréquence d’apparition des symptômes. Si la prédominance des symptômes est nocturne, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sera administré le soir ; si elle est diurne, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sera administré le matin.
Le dosage de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER qui sera prescrit au patient devra correspondre à la dose de propionate de fluticasone adaptée à la sévérité de son asthme. Si les dosages disponibles de cette association fixe ne répondent pas aux nécessités pour ajuster les posologies en fonction de l’état du patient, β2 agonistes et/ou corticoïdes devront être prescrits individuellement.
Posologie préconisée
Asthme
Adultes et adolescents de 12 ans et plus :
· une inhalation de 100 microgrammes de propionate de fluticasone et 50 microgrammes de salmétérol 2 fois par jour
ou
· une inhalation de 250 microgrammes de propionate de fluticasone et 50 microgrammes de salmétérol 2 fois par jour
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut être envisagé en traitement d’initiation pendant une courte période d’essai chez des adultes et adolescents ayant un asthme persistant modéré (défini par l’existence d’une symptomatologie diurne, l’utilisation quotidienne d’un bronchodilatateur de courte durée d’action en traitement symptomatique de secours et une obstruction bronchique modérée à sévère) et chez qui il apparaît essentiel d’obtenir un contrôle rapide de l’asthme. Dans ces cas, la dose initiale recommandée est d'une inhalation de 50 microgrammes de salmétérol et 100 microgrammes de propionate de fluticasone, deux fois par jour. Lorsque le contrôle de l’asthme est obtenu, le traitement doit être réévalué afin d’envisager la réduction du traitement à un corticoïde inhalé seul. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement.
Il n’a pas été établi de bénéfice évident de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER utilisé en traitement d’initiation par rapport à un traitement inhalé par propionate de fluticasone seul, lorsque 1 à 2 des critères de sévérité évoqués ci-dessus ne sont pas présents. Dans la majorité des cas, le traitement de première intention demeure l’administration de corticoïdes inhalés seuls.
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n’est pas destiné au traitement de première intention de l’asthme léger. Le dosage 100 microgrammes/50 microgrammes/ dose de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ne convient pas aux adultes et aux enfants atteints d’asthme sévère ; la dose appropriée de corticoïdes inhalés devra être ajustée individuellement avant d’instaurer un traitement par une association fixe chez des patients atteints d’asthme sévère.
Population pédiatrique
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n'est pas recommandé chez les enfants âgés de moins de 12 ans. La sécurité et l'efficacité de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER chez les enfants âgés de moins de 12 ans n'ont pas été établies.
Populations à risque
Il n’y a pas lieu d’ajuster les doses chez les sujets âgés ou atteints d’insuffisance rénale.
Aucune donnée n’est disponible concernant l’utilisation de PROPIONATE DE FLUTICASONE/ SALMETEROL ARROW AIRMASTER chez les patients atteints d’insuffisance hépatique.
Mode d'administration
Voir inhalée.
Formation requise
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être utilisé correctement afin d’obtenir un traitement efficace. Tous les patients doivent être invités à lire attentivement la notice et à respecter les instructions d'utilisation décrites dans la notice. Tous les patients doivent être formés par le professionnel de la santé traitant à l'utilisation de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, en particulier s'il s'agit de leur première utilisation de cet inhalateur. Cela permet de s'assurer qu'ils comprennent bien comment l’utiliser correctement.
L’utilisation de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER suit trois étapes simples, décrites ci-dessous :
1. Le dispositif s’ouvre en appuyant sur le cran de sécurité rouge et est amorcé en faisant coulisser le capuchon rose clair de l'embout buccal jusqu'à entendre un « clic ».
2. Le patient doit d’abord expirer. L'embout buccal est ensuite placé entre les lèvres. La dose peut alors être inhalée en inspirant régulièrement et profondément. L'inhalateur est ensuite retiré de la bouche et le patient doit retenir son souffle pendant environ 10 secondes ou aussi longtemps que possible sans effort.
3. Le patient doit alors être invité à expirer doucement et à refermer le couvercle de l'inhalateur jusqu'à entendre un « clic ».
Les patients doivent également être invités à se rincer ensuite la bouche avec de l'eau, de la recracher et/ou de se brosser les dents après avoir inhalé.
Hypersensibilité aux substances actives ou à l'un des excipients mentionnés à la rubrique 6.1.
4.4. Mises en garde spéciales et précautions d'emploi 
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n’est pas adapté au traitement des crises d’asthme et des épisodes de dyspnée paroxystique. Dans ces situations, le patient devra avoir recours à un bronchodilatateur à action rapide et de courte durée pour traiter les symptômes aigus.
Le patient sera informé qu’il doit ainsi avoir en permanence à sa disposition un médicament bronchodilatateur à action rapide et de courte durée destiné à être utilisé en cas de crise d’asthme.
Le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ne doit pas être initié pendant une phase d’exacerbation ni en cas d’aggravation significative ou de détérioration aiguë de l’asthme.
Des évènements indésirables graves liés à l’asthme et des exacerbations peuvent survenir lors du traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER. Il convient d’informer les patients que si les symptômes de l’asthme persistent ou s’aggravent au cours du traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, ils doivent continuer leur traitement, mais prendre avis auprès de leur médecin.
Une augmentation de la consommation de médicaments bronchodilatateurs à action rapide et de courte durée (dits « médicaments de secours ») ou une diminution de la réponse à ceux-ci est le signe d’une déstabilisation de la maladie. Dans ce cas, le patient devra consulter son médecin.
Une détérioration plus ou moins rapide du contrôle des symptômes doit faire craindre une évolution vers un asthme aigu grave pouvant mettre en jeu le pronostic vital et, par conséquent, nécessite une consultation médicale urgente. Il conviendra alors d’envisager une augmentation de la corticothérapie.
Dès que les symptômes de l’asthme sont contrôlés, une diminution progressive de la dose de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être envisagée. Il est important que les patients soient suivis régulièrement lors de la période de réduction du traitement. La dose minimale efficace de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être utilisée (voir rubrique 4.2).
Arrêt du traitement
Chez les patients asthmatiques, le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ne devra pas être interrompu brusquement en raison d’un risque d’exacerbation. Par ailleurs, il conviendra de toujours rechercher la posologie minimale efficace sous contrôle médical.
Précautions avec les maladies particulières
Comme les autres corticoïdes destinés à être administrés par voie inhalée, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être utilisé avec précaution chez les patients atteints de tuberculose pulmonaire active ou quiescente, d’infections fongiques et virales ou d’autres infections des voies respiratoires. Un traitement approprié doit être instauré rapidement si nécessaire.
Effets cardiovasculaires
Rarement, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut entraîner des troubles du rythme cardiaque tels que tachycardie supraventriculaire, extrasystoles et fibrillation auriculaire, ainsi qu’une baisse modérée et transitoire de la kaliémie à des doses thérapeutiques élevées. PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être utilisé avec prudence en cas de pathologies cardiovasculaires sévères ou de troubles du rythme cardiaque et chez les patients présentant un diabète, une hyperthyroïdie, une hypokaliémie non corrigée ou à risque d’hypokaliémie.
Hyperglycémie
Des augmentations de la glycémie ont été très rarement rapportées (voir rubrique 4.8). Ceci doit être pris en compte lors de la prescription à des patients diabétiques.
Bronchospasme paradoxal
Comme avec d’autres traitements inhalés, un bronchospasme paradoxal peut survenir, caractérisé par une augmentation des sifflements et un essoufflement survenant immédiatement après l’administration. Le bronchospasme paradoxal doit être traité immédiatement avec un bronchodilatateur d’action rapide et de courte durée. Il convient alors de cesser toute administration de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, d'évaluer l'état du patient et au besoin, d’instaurer un traitement alternatif.
Agonistes des adrénorécepteurs bêta 2
Les effets indésirables pharmacologiques des traitements β2 agonistes, tels que tremblements, palpitations et maux de tête ont été rapportés, mais ces manifestations sont généralement transitoires et s'atténuent au cours d'un traitement régulier.
Excipients
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER contient du lactose. Les patients présentant des problèmes héréditaires rares d'intolérance au galactose, de déficit total en lactase ou de malabsorption du glucose-galactose ne doivent pas prendre ce médicament.
Effets systémiques de la corticothérapie
La corticothérapie inhalée peut entraîner des effets systémiques, en particulier lors de traitements à fortes doses au long cours. La survenue de ces effets reste cependant moins probable qu'au cours d'une corticothérapie orale. Il peut être observé un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, une diminution de la densité minérale osseuse, une cataracte et un glaucome et, plus rarement, divers effets psychologiques ou comportementaux incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité (en particulier chez l’enfant) (voir la sous-rubrique Population pédiatrique ci-dessous pour plus d’informations sur les effets systémiques des corticoïdes inhalés chez les enfants et les adolescents). En conséquence, le patient sera suivi régulièrement et la posologie minimale efficace devra toujours être recherchée.
Fonction surrénalienne
L’administration prolongée de doses élevées de corticoïdes par voie inhalée peut provoquer une inhibition de la fonction surrénalienne et une insuffisance surrénalienne aiguë. Des cas d’inhibition de la fonction surrénalienne et d’insuffisance surrénalienne aiguë ont également été très rarement décrits avec des doses de propionate de fluticasone comprises entre 500 et 1 000 microgrammes. Les crises d’insuffisance surrénalienne peuvent être déclenchées par un traumatisme, une intervention chirurgicale, une infection ou toute diminution rapide de la posologie. Le tableau clinique est généralement atypique pouvant comprendre anorexie, douleur abdominale, perte de poids, fatigue, maux de tête, nausées, vomissements, hypotension, troubles de la conscience, hypoglycémie et convulsions. En cas de stress ou lorsqu'une intervention chirurgicale est prévue, une corticothérapie de supplémentation par voie générale peut être nécessaire.
L'administration de propionate de fluticasone par voie inhalée favorise la diminution du recours aux corticoïdes oraux pour traiter l'asthme, mais elle ne prévient pas le risque d'apparition d'une insuffisance surrénalienne lors du sevrage des patients traités au long cours par une corticothérapie orale. Par conséquent, ces patients doivent être traités avec précaution et leur fonction corticosurrénalienne régulièrement surveillée. Ce risque existe également chez les patients ayant reçu de fortes doses de corticoïdes en urgence. Le risque de persistance d'une inhibition des fonctions surrénaliennes doit rester présent à l'esprit dans les situations d'urgence et/ou lors d’interventions chirurgicales prévues susceptibles de déclencher un état de stress. Une corticothérapie substitutive adaptée devra être envisagée. Un avis spécialisé peut être requis avant une intervention chirurgicale prévue en fonction de la sévérité de l’insuffisance surrénalienne.
Interactions avec d’autres médicaments
Le ritonavir peut augmenter considérablement les concentrations plasmatiques de propionate de fluticasone. Par conséquent, à moins que le bénéfice attendu pour le patient ne l’emporte sur le risque d’effets indésirables systémiques de la corticothérapie, il convient d’éviter de les administrer de façon concomitante. Le risque d’effets systémiques de la corticothérapie est également augmenté en cas d’administration concomitante de propionate de fluticasone avec d’autres inhibiteurs puissants du cytochrome P450 3A4 (voir rubrique 4.5).
L’administration concomitante de kétoconazole par voie systémique augmente de manière significative l’exposition systémique au salmétérol pouvant entraîner une augmentation du risque de survenue d’effets systémiques (par exemple : prolongation de l’intervalle QTc et palpitations). Par conséquent, il convient d’éviter l’administration concomitante de kétoconazole ou d’autres inhibiteurs puissants du cytochrome P450 3A4 sauf si les bénéfices attendus l’emportent sur le risque potentiel de survenue d’événements indésirables systémiques du salmétérol (voir rubrique 4.5).
Troubles visuels
Des troubles visuels peuvent apparaitre lors d'une corticothérapie par voie systémique ou locale. En cas de vision floue ou d'apparition de tout autre symptôme visuel apparaissant au cours d'une corticothérapie, un examen ophtalmologique est requis à la recherche notamment d'une cataracte, d'un glaucome, ou d'une lésion plus rare telle qu'une choriorétinopathie séreuse centrale (CSCR), décrits avec l'administration de corticostéroïdes par voie systémique ou locale.
Population pédiatrique
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n'est pas recommandé chez les enfants âgés de moins de 12 ans (voir rubrique 4.2).
Les adolescents de moins de 16 ans recevant de fortes doses de propionate de fluticasone (généralement ≥ 1 000 microgrammes par jour) sont particulièrement à risque. Des effets systémiques peuvent survenir, en particulier lors de traitements à fortes doses au long cours. Il peut être observé un syndrome de Cushing, un tableau cushingoïde, une inhibition de la fonction surrénalienne, une insuffisance surrénalienne aiguë et un retard de croissance chez les adolescents et, plus rarement, divers effets psychologiques ou comportementaux incluant hyperactivité psychomotrice, troubles du sommeil, anxiété, dépression ou agressivité. Il convient alors d’adresser l'enfant ou l'adolescent à un pédiatre spécialisé en pneumologie.
La croissance des adolescents recevant une corticothérapie inhalée à long terme devra être régulièrement surveillée. La corticothérapie inhalée devra être réduite à la plus faible dose assurant un contrôle efficace de l’asthme.
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Les β-bloquants adrénergiques peuvent diminuer ou antagoniser l'effet du salmétérol. Les β-bloquants, sélectifs ou non, doivent être évités chez les patients atteints d’asthme sauf nécessité absolue. Une hypokaliémie potentiellement grave peut survenir suite à un traitement par agoniste β2. Une attention particulière est recommandée en cas d’asthme aigu sévère en raison du risque d’aggravation de cette hypokaliémie par l’administration d’un traitement concomitant à base de dérivés de la xanthine, de stéroïdes et de diurétiques.
L’administration concomitante d’autres médicaments β-adrénergiques peut potentialiser les effets β2-mimétiques.
Propionate de fluticasone
Dans les conditions normales d’emploi, les concentrations plasmatiques de propionate de fluticasone atteintes après administration par voie inhalée sont faibles du fait d’un effet de premier passage présystémique important (hépatique et intestinal) et d’une forte clairance plasmatique par une importante métabolisation médiée par le cytochrome CYP3A4. Par conséquent, le risque d’interactions cliniquement significatives avec d’autres substances actives médiées par le propionate de fluticasone semble faible.
Néanmoins, une étude d’interaction chez des volontaires sains recevant du propionate de fluticasone par voie nasale a montré que le ritonavir (un inhibiteur très puissant du cytochrome CYP3A4) à la dose de 100 mg deux fois par jour augmentait de plusieurs centaines de fois les concentrations plasmatiques de propionate de fluticasone, entraînant une diminution marquée des concentrations en cortisol plasmatique.
Il n’y a pas de donnée documentant l’interaction avec le propionate de fluticasone administré par voie inhalée, mais une augmentation importante des concentrations plasmatiques est attendue ; des cas de syndrome de Cushing et d’inhibition de la fonction surrénalienne ont été rapportés. Il convient donc d’éviter l’administration concomitante de propionate de fluticasone et de ritonavir, à moins que le bénéfice ne l’emporte sur le risque accru d’effets systémiques de la corticothérapie.
Une étude de faible effectif menée chez des volontaires sains a montré que le kétoconazole, inhibiteur un peu moins puissant du CYP3A4, augmentait de 150 % l’exposition systémique d’une dose de propionate de fluticasone par voie inhalée. La réduction du cortisol plasmatique était plus importante que celle observée après l’administration de propionate de fluticasone seul. Une augmentation de l’exposition systémique et du risque d’effets indésirables systémiques est attendue en cas d’administration concomitante d’autres inhibiteurs puissants du CYP3A4 (ex : itraconazole et médicaments contenant du cobicistat) et d’inhibiteurs modérés du CYP3A4 (ex : érythromycine). L'administration concomitante doit être évitée sauf si les bénéfices attendus sont supérieurs au risque accru d'effets secondaires systémiques des corticostéroïdes, auquel cas, les patients doivent être surveillés en vue de détecter les éventuels effets secondaires systémiques des corticostéroïdes.
Salmétérol
Inhibiteurs puissants du CYP3A4
L’administration concomitante de kétoconazole (400 mg par voie orale une fois par jour) et de salmétérol (50 µg par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 7 jours a entraîné une augmentation significative des concentrations plasmatiques de salmétérol (Concentration maximale (Cmax) augmentée d’un facteur 1,4 et aire sous la courbe (ASC) augmentée d’un facteur 15). Cette observation suggère donc une augmentation du risque de survenue des effets systémiques du salmétérol, tels que prolongation de l’intervalle QT et palpitations, par rapport à l’administration de salmétérol ou de kétoconazole seuls (voir rubrique 4.4).
Il n’a pas été observé d’effet cliniquement significatif sur la pression artérielle, la fréquence cardiaque, la glycémie et la kaliémie. L’administration concomitante de kétoconazole n’a pas entraîné de prolongation de la demi-vie d’élimination du salmétérol ni son accumulation après administrations répétées.
Il convient d’éviter l’association de kétoconazole avec un traitement par salmétérol sauf si les bénéfices attendus l’emportent sur le risque potentiel de survenue d’effets systémiques du salmétérol. Un risque d’interaction du même ordre est attendu avec d’autres inhibiteurs puissants du cytochrome P450 3A4 (par exemple avec l’itraconazole, la télithromycine, le ritonavir).
Inhibiteurs modérés du CYP3A4
L’administration concomitante d’érythromycine (500 mg par voie orale trois fois par jour) et de salmétérol (50 microgrammes par voie inhalée deux fois par jour) chez 15 volontaires sains pendant 6 jours a entraîné une légère augmentation, mais non statistiquement significative, des concentrations plasmatiques du salmétérol (Cmax augmentée d’un facteur 1,4 et ASC augmentée d’un facteur 1,2). Aucune réaction indésirable grave n’a été associée à l’administration concomitante avec l’érythromycine.
4.6. Fertilité, grossesse et allaitement 
Fertilité
Il n’existe pas de données chez l’Homme. Cependant, les études menées chez l’animal n’ont montré aucun effet du salmétérol ou du propionate de fluticasone sur la fécondité.
Grossesse
Une quantité importante de données obtenues chez la femme enceinte (plus de 1 000 cas de grossesses documentées) ne rapportent pas de toxicité malformative ou fœto/néonale en relation avec le salmétérol et le propionate de fluticasone. Les études menées chez l’animal sur les fonctions de reproduction ont mis en évidence une toxicité des β2 mimétiques et des glucocorticoïdes (voir rubrique 5.3).
L’utilisation de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER au cours de la grossesse ne devra être envisagée que si le bénéfice attendu pour la mère l’emporte sur tout risque éventuel pour le fœtus.
Chez la femme enceinte, il conviendra de toujours rechercher la dose minimale efficace de propionate de fluticasone assurant un contrôle satisfaisant des symptômes de l’asthme.
Le passage dans le lait maternel du salmétérol et du propionate de fluticasone et de leurs métabolites n’est pas connu.
Des études ont mis en évidence que le salmétérol et le propionate de fluticasone, et leurs métabolites, sont excrétés dans le lait des rates allaitantes.
Un risque pour les nouveau-nés/nourrissons nourris au sein ne peut être exclu. La décision d’interruption de l’allaitement ou du traitement par propionate de fluticasone/salmétérol sera établie en fonction du bénéfice attendu de l'allaitement maternel pour l'enfant face à celui du traitement pour la femme qui allaite.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER contient du salmétérol et du propionate de fluticasone, dont les effets indésirables sont connus. Aucun effet indésirable nouveau n’est apparu lors de l’administration conjointe des deux principes actifs dans la même formulation.
Les effets indésirables associés au propionate de fluticasone/salmétérol sont indiqués ci-dessous, par classe de systèmes d'organes et par fréquence. Les fréquences sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (< 1/10 000 à < 1/1 000) et indéterminé (ne peut pas être estimée sur la base des données disponibles).
Les fréquences ont été définies sur la base des essais cliniques. L’incidence correspondante dans le bras placebo n’a pas été prise en considération.
|
Classes de système d'organe |
Effets indésirables |
Fréquence |
|
Infections et infestations |
Candidose buccale et pharyngée |
Fréquent |
|
Candidose œsophagienne |
Rare |
|
|
Troubles du système immunitaire |
Réactions d'hypersensibilité avec les manifestations suivantes : |
|
|
Réactions cutanées d'hypersensibilité |
Peu fréquent |
|
|
Angiœdème (principalement œdème facial et oropharyngé) |
Rare |
|
|
Symptômes respiratoires (dyspnée) |
Peu fréquent |
|
|
Symptômes respiratoires (bronchospasme) |
Rare |
|
|
Réactions anaphylactiques incluant le choc anaphylactique |
Rare |
|
|
Troubles endocriniens |
Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne, ralentissement de la croissance chez l'enfant et l'adolescent, diminution de la densité minérale osseuse |
Rare2 |
|
Troubles du métabolisme et de la nutrition |
Hyperglycémie |
Peu fréquent2 |
|
Troubles psychiatriques |
Anxiété |
Peu fréquent |
|
Troubles du sommeil |
Peu fréquent |
|
|
Modifications du comportement incluant hyperactivité psychomotrice et irritabilité (principalement chez les enfants) |
Rare |
|
|
Dépression, agressivité (principalement chez les enfants) |
Fréquence indéterminée |
|
|
Troubles du système nerveux |
Maux de tête |
Très fréquent1 |
|
Tremblements |
Peu fréquent |
|
|
Troubles oculaires |
Cataracte |
Peu fréquent |
|
Glaucome |
Rare2 |
|
|
Vision floue (voir rubrique 4.4) |
Fréquence indéterminée2 |
|
|
Troubles cardiaques |
Palpitations |
Peu fréquent |
|
Tachycardie |
Peu fréquent |
|
|
Arythmies cardiaques (y compris tachycardie supraventriculaire et extrasystoles) |
Rare |
|
|
Fibrillation auriculaire |
Peu fréquent |
|
|
Angine de poitrine |
Peu fréquent |
|
|
Troubles respiratoires, thoraciques et médiastinaux |
Gêne pharyngée |
Fréquent |
|
Raucité de la voix/dysphonie |
Fréquent |
|
|
Bronchospasme paradoxal |
Rare2 |
|
|
Troubles musculo‑squelettiques et systémiques |
Crampes musculaires |
Fréquent |
|
Arthralgie |
Fréquent |
|
|
Myalgie |
Fréquent |
1. Rapportés fréquemment dans les groupes placebo.
2. Voir rubrique 4.4.
Description de certains effets indésirables
Des effets secondaires liés aux propriétés pharmacologiques β2 mimétiques du salmétérol, tels que tremblements, palpitations et maux de tête, ont été rapportés. Ils sont le plus souvent transitoires et diminuent avec la poursuite du traitement.
Comme avec d’autres traitements inhalés, un bronchospasme paradoxal peut survenir, caractérisé par une augmentation des sifflements et un essoufflement survenant immédiatement après l’administration. Le bronchospasme paradoxal doit être traité immédiatement avec un bronchodilatateur d’action rapide et de courte durée. Il convient alors de cesser toute administration de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, d'évaluer l'état du patient et au besoin, d’instaurer un traitement alternatif.
Des effets indésirables associés au propionate de fluticasone comme une raucité de la voix et une candidose (muguet) buccale et pharyngée, et rarement œsophagienne, peuvent survenir chez certains patients. L’enrouement et les candidoses peuvent être réduits par le rinçage de la bouche à l’eau et/ou le brossage des dents après utilisation de PROPIONATE DE FLUTICASONE/ SALMETEROL ARROW AIRMASTER. Les candidoses buccales et pharyngées symptomatiques peuvent être traitées par des antifongiques locaux tout en continuant le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER.
Population pédiatrique
Les effets systémiques, tels que Syndrome de Cushing, tableau cushingoïde, inhibition de la fonction surrénalienne et ralentissement de la croissance chez l’enfant et chez l’adolescent, sont possibles (voir rubrique 4.4). Anxiété, troubles du sommeil et modifications du comportement, incluant hyperactivité et irritabilité, peuvent également survenir chez les enfants.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Salmétérol
Les signes et symptômes d’un surdosage en salmétérol sont des vertiges, une augmentation de la pression artérielle systolique, des tremblements, des céphalées et une tachycardie. Si le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être interrompu en raison d’une exposition excessive aux β2 mimétiques, il sera remplacé par un corticoïde seul. Si une hypokaliémie apparaît, elle devra être corrigée par un apport adapté de potassium et la kaliémie devra être surveillée.
Propionate de fluticasone
Surdosage aigu : l'administration de propionate de fluticasone à des doses supérieures à celles recommandées par voie inhalée peut entraîner une inhibition temporaire de la fonction surrénalienne. Il n’y a pas lieu d’adopter une mesure d’urgence car la fonction surrénalienne se rétablit en quelques jours comme en témoignent les mesures du cortisol plasmatique.
Surdosage chronique en propionate de fluticasone inhalé : la fonction surrénalienne doit être surveillée et un traitement à base de corticoïde systémique peut alors être nécessaire. Une fois stabilisé, le traitement doit être poursuivi avec un corticoïde inhalé à la dose recommandée. Se reporter à la rubrique 4.4, Risque d’inhibition surrénalienne.
En cas de surdosage aigu ou chronique en propionate de fluticasone, le traitement par PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être poursuivi en ajustant la posologie aux doses suffisantes pour un contrôle optimal des symptômes de l’asthme.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : Adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques, code ATC : R03AK06.
Mécanisme d'action et effets pharmacodynamiques
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER contient du salmétérol et du propionate de fluticasone qui ont des modes d'action différents. Les mécanismes d'action respectifs de ces deux principes actifs sont présentés ci-après.
Salmétérol
Le salmétérol est un agoniste sélectif de longue durée d'action (12 heures) des récepteurs β2‑adrénergiques. Il possède une longue chaîne latérale qui le lie à l'exo-site du récepteur.
Le salmétérol produit une bronchodilatation qui persiste pendant environ 12 heures. Cette durée est supérieure à celle observée généralement avec les β2 mimétiques de courte durée d'action administrés aux posologies usuelles.
Propionate de fluticasone
Le propionate de fluticasone administré par voie inhalée aux doses préconisées exerce une activité glucocorticoïde entraînant un effet anti-inflammatoire local au niveau de la muqueuse bronchique. En conséquence, les symptômes et les exacerbations d'asthme sont diminués alors que les réactions systémiques indésirables sont limitées comparativement à l'administration de corticoïdes par voie générale.
Efficacité et sécurité clinique
Les études décrites ci-dessous (GOAL et SMART) ont été réalisées avec la même combinaison à dose fixe, le xinafoate de salmétérol et le propionate de fluticasone, mais ont étudié un produit précédemment autorisé ; les études décrites n'ont pas été réalisées avec PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER.
Études cliniques conduites avec l’association propionate de fluticasone/salmétérol dans l'asthme
Une étude de 12 mois (Gaining Optimal Asthma controL, GOAL), réalisée chez 3 416 patients adultes et adolescents atteints d'asthme persistant, a comparé la sécurité et l'efficacité du propionate de fluticasone/salmétérol à une corticothérapie inhalée seule (propionate de fluticasone) afin d’évaluer la possibilité d’atteindre l’objectif de prise en charge de l’asthme. La posologie du traitement était augmentée toutes les 12 semaines jusqu'à ce qu'un contrôle total** ait été obtenu ou que la posologie la plus élevée du médicament de l'étude ait été atteinte. GOAL a montré qu’il y avait plus de patients qui atteignaient le contrôle de l’asthme lorsqu’ils étaient traités par salmétérol/propionate de fluticasone que lors d’un traitement par corticoïdes inhalés seuls, ce contrôle étant obtenu avec une moindre dose de corticoïdes.
Un bon contrôle* de l’asthme a été obtenu plus rapidement chez les patients traités par salmétérol/propionate de fluticasone que chez les patients traités par un corticoïde inhalé seul. Le temps nécessaire pour que 50 % des sujets inclus dans l’étude atteignent leur première semaine de bon contrôle* a été de 16 jours pour les sujets traités par salmétérol/propionate de fluticasone et de 37 jours pour ceux traités par corticostéroïdes inhalés (CSI). Dans le sous-groupe des patients asthmatiques non traités préalablement par des corticoïdes inhalés, ce temps était respectivement de 16 jours avec salmétérol/propionate de fluticasone et de 23 jours avec les CSI.
Les résultats globaux de l’étude étaient les suivants :
|
Pourcentage de patients atteignant le Bon Contrôle* (BC) et le Contrôle Total** (CT) de l'asthme sur 12 mois |
||||
|
Traitement avant inclusion dans l'étude |
PF/Salmétérol |
PF |
||
|
BC |
CT |
BC |
CT |
|
|
Aucun CSI (β2 CDA seul) |
78 % |
50 % |
70 % |
40 % |
|
CSI à faible dose (≤ 500 µg de BDP ou équivalent par jour) |
75 % |
44 % |
60 % |
28 % |
|
CSI à dose moyenne (> 500 à 1 000 µg de BDP ou équivalent par jour) |
62 % |
29 % |
47 % |
16 % |
|
Résultats globaux (quel que soit le traitement antérieur) |
71 % |
41 % |
59 % |
28 % |
*Bon contrôle de l'asthme : 2 jours par semaine maximum avec un score des symptômes supérieur à 1 (un score des symptômes de 1 est défini comme « présence de symptômes pendant une courte période pendant la journée »), utilisation d’un bronchodilatateur bêta-2 agoniste de courte durée d’action : 2 jours maximum par semaine et 4 fois maximum par semaine, valeur du débit expiratoire de pointe mesuré le matin ≥ 80 % de la valeur théorique, pas de réveil nocturne, ni exacerbation, ni effet indésirable entraînant une modification de traitement.
**Contrôle total de l'asthme : pas de symptômes, pas d’utilisation d’un bronchodilatateur bêta-2 agoniste de courte durée d’action, valeur du débit expiratoire de pointe mesuré le matin supérieure ou égale à 80 % de la valeur théorique, pas de réveil nocturne, ni exacerbation, ni effet indésirable entraînant une modification de traitement.
Les résultats de cette étude suggèrent que le propionate de fluticasone/salmétérol 100/ 50 microgrammes/dose, deux fois par jour, peut être envisagé en initiation d’un traitement de fond chez des patients ayant un asthme persistant modéré chez qui il apparaît essentiel d’obtenir un contrôle rapide de l’asthme (voir rubrique 4.2).
Une étude en double aveugle, randomisée en groupes parallèles, conduite chez 318 patients d’au moins 18 ans, atteints d’asthme persistant, a évalué la sécurité et la tolérance de l’administration de deux inhalations deux fois par jour (double dose) de salmétérol/propionate de fluticasone pendant deux semaines. Cette étude a montré que le doublement de la dose de salmétérol/propionate de fluticasone (quel que soit le dosage), sur une durée allant jusqu’à 14 jours, entraîne par rapport à l’administration d’une inhalation deux fois par jour, une légère augmentation des effets indésirables liés à l’activité β2 mimétique (tremblements : 1 patient [1 %] vs 0, palpitations : 6 [3 %] vs 1 [<1 %], crampes musculaires : 6 [3 %] vs 1 [<1 %]) et une incidence similaire des effets indésirables liés au corticoïde inhalé (candidose orale : 6 [6 %] vs 16 [8 %], raucité de la voix : 2 [2 %] vs 4 [2 %]). La faible augmentation des effets indésirables liés à l’activité bêta-mimétique doit être prise en considération, s’il est envisagé de doubler la dose prescrite de salmétérol/propionate de fluticasone chez des patients adultes qui nécessiteraient une augmentation de la corticothérapie inhalée pendant une courte période (jusqu’à 14 jours).
Asthme
Essai multicentrique dans l’asthme avec le salmétérol (« Salmeterol Multi-Center Asthma Research Trial, SMART »)
L’étude SMART (Salmeterol Multi-center Asthma Research Trial) était une étude de 28 semaines réalisée aux États-Unis chez des patients adultes et adolescents afin d’évaluer la sécurité du salmétérol comparé au placebo ajouté au traitement habituel. Bien qu’aucune différence significative n’ait été observée pour le critère principal d’évaluation, critère combiné associant le nombre de décès liés à une cause respiratoire et le nombre de détresses respiratoires mettant en jeu le pronostic vital, l’étude a montré une augmentation significative du nombre de décès liés à l’asthme chez les patients recevant du salmétérol (13 décès chez les 13 176 patients traités par salmétérol comparé à 3 décès chez les 13 179 patients recevant le placebo).
L’étude n’était pas conçue pour évaluer l’impact des corticostéroïdes inhalés administrés en parallèle ; à l’inclusion, l’utilisation de CSI n’a été rapportée que chez 47 % des patients.
Sécurité et efficacité de l’association propionate de fluticasone/salmétérol versus propionate de fluticasone en monothérapie dans l’asthme
Deux études multi-centriques de 26 semaines ont été réalisées afin de comparer la sécurité et l’efficacité de l’association propionate de fluticasone/salmétérol versus propionate de fluticasone en monothérapie : une chez des patients adultes et adolescents (étude AUSTRI) et l’autre chez des patients pédiatriques âgés de 4 à 11 ans (étude VESTRI). Pour les deux études, les patients inclus présentaient un asthme persistant modéré à sévère, associé à des antécédents d’hospitalisations liées à l’asthme ou à des épisodes d’exacerbation au cours de l’année précédente. Le critère principal d’évaluation de chaque étude consistait à déterminer si l’ajout de LABA au traitement par CSI (propionate de fluticasone/salmétérol) était non-inférieur au CSI administré seul en termes de risque d’évènements indésirables graves liés à l’asthme (hospitalisation due à l’asthme, intubation endotrachéale et décès). Un objectif secondaire d’efficacité de ces études consistait à évaluer si l’association CSI/LABA (propionate de fluticasone/salmétérol) était supérieure au traitement par CSI seuls (propionate de fluticasone) en termes d’exacerbation sévère de l’asthme (définie comme une détérioration de l’asthme nécessitant l’utilisation de corticostéroïdes par voie systémique pendant au moins 3 jours ou bien une hospitalisation ou une consultation dans un service d’urgences pour un asthme qui requière l’utilisation de corticostéroïdes par voie systémique).
Un total de respectivement 11 679 et 6 208 patients ont été randomisés afin de recevoir le traitement défini dans le cadre des études AUSTRI et VESTRI. En ce qui concerne le critère principal d’évaluation, une non-infériorité a été démontrée dans les deux études (voir tableau ci-dessous).
Effets indésirables graves liés à l’asthme rapportés dans les études de 26 semaines AUSTRI et VESTRI
|
AUSTRI |
VESTRI |
|||
|
PF-Salmétérol (n = 5 834) |
PF en monthérapie (n = 5 845) |
PF-Salmétérol (n = 3 107) |
PF en monothérapie (n = 3 101) |
|
|
Critère d’évaluation composite (hospitalisation liée à l’asthme, intubation endotrachéale ou décès) |
34 (0,6 %) |
33 (0,6 %) |
27 (0,9 %) |
21 (0,7 %) |
|
PF-Salmétérol/PF Hazard ratio (IC 95 %) |
1 ,029 (0,638-1,662)a |
1,285 (0,726-2,272)b |
||
|
Décès |
0 |
0 |
0 |
0 |
|
Hospitalisation liée à l’asthme |
34 |
33 |
27 |
21 |
|
Intubation endotrachéale |
0 |
2 |
0 |
0 |
a L’obtention d’une estimation supérieure de l’IC 95 % du risque relatif inférieure à 2,0 a permis de conclure à une non-infériorité.
b L’obtention d’une estimation supérieure de l’IC 95 % du risque relatif inférieure à 2,675 a permis de conclure à une non-infériorité.
Pour le critère d’évaluation secondaire, une réduction du délai de survenue de la première exacerbation de l’asthme avec l’association PF-salmétérol par rapport au PF seul a été observée dans les deux études, cependant cette réduction n’a été statistiquement significative que dans l’étude AUSTRI.
|
AUSTRI |
VESTRI |
|||
|
PF-Salmétérol (n = 5834) |
PF en monothérapie (n = 5845) |
PF-Salmétérol (n = 3107) |
PF en monothérapie (n = 3101) |
|
|
Nombre de sujets présentant une exacerbation de leur asthme |
480 (8 %) |
597 (10 %) |
265 (9 %) |
309 (10 %) |
|
PF-Salmétérol/PF Hazard ratio (IC 95 %) |
0,787 (0,698 ; 0,888) |
0,859 (0,729 ; 1,012) |
||
Population pédiatrique
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n'est pas indiqué chez les enfants âgés de moins de 12 ans (voir rubrique 4.2). Les études décrites ci-dessous ont été réalisées avec un produit préalablement autorisé ; les études décrites n'ont pas été réalisées avec PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER.
Dans l'étude SAM101667, conduite chez 158 enfants âgés de 6 à 16 ans présentant un asthme symptomatique, l’association propionate de fluticasone/ salmétérol était aussi efficace qu’une double dose de propionate de fluticasone sur le contrôle des symptômes et sur la fonction pulmonaire. Cette étude n'était pas conçue pour l’étude de l'effet sur les exacerbations.
Dans une étude de 12 semaines conduite chez des enfants âgés de 4 à 11 ans [n = 257] traités par l’association propionate de fluticasone/ salmétérol 100/50 microgrammes 2 fois par jour ou par salmétérol 50 microgrammes et propionate de fluticasone 100 microgrammes 2 fois par jour, une augmentation moyenne de 14 % du débit expiratoire de pointe (DEP ou Peak Expiratory flow) ainsi qu’une amélioration des scores de sévérité des symptômes et une diminution de la consommation de traitement dit « de secours » (salbutamol) ont été observées dans les deux groupes comparés. Aucune différence n’a été observée entre les deux groupes de traitement. De même, il n’a pas été montré de différence entre les deux groupes de traitement en termes de sécurité.
Une étude de 12 semaines, randomisée, en groupes parallèles dont l’objectif principal était d’évaluer la sécurité a été menée chez des enfants âgés de 4 à 11 ans [n = 203] présentant un asthme persistant et qui restaient symptomatiques malgré un traitement par corticostéroïde inhalé. Les enfants ont reçu soit l’association propionate de fluticasone/salmétérol (100/50 microgrammes) soit du propionate de fluticasone (100 microgrammes) seul à raison de deux prises par jour. Deux enfants du groupe propionate de fluticasone/salmétérol et 5 enfants du groupe propionate de fluticasone seul ont été retirés de l’étude en raison de l'aggravation de leur asthme. Après 12 semaines, aucun des enfants des deux groupes de traitement n’avait de taux anormaux d’excrétion du cortisol urinaire sur 24 heures. Il n'y avait pas de différence de profil de sécurité entre les deux groupes de traitement.
Médicaments anti-asthmatiques contenant du propionate de fluticasone utilisés pendant la grossesse
Une étude de cohorte épidémiologique rétrospective observationnelle a été réalisée sur la base de dossiers médicaux électroniques émanant du Royaume-Uni afin d’évaluer le risque de MCM (Malformations congénitales majeures) suite à l’exposition au propionate de fluticasone inhalé seul et à l’association PF/salmétérol comparativement à un traitement par CSI ne contenant pas de propionate de fluticasone, pendant le premier trimestre de la grossesse. Aucun comparateur par placebo n’a été inclus dans cette étude.
Au sein de la cohorte « asthme » de 5 362 grossesses exposées aux CSI au cours du premier trimestre, 131 MCM diagnostiquées ont été identifiées ; 1 612 (30 %) grossesses ont été exposées au propionate de fluticasone ou à l’association propionate de fluticasone/salmétérol, parmi lesquelles 42 MCM diagnostiquées ont été identifiées. Les « odds ratio » ajustés pour les MCMs diagnostiquées en un an étaient de 1,1 (IC 95 % ; 0,5 – 2,3) pour les femmes présentant un asthme modéré et exposées au propionate de fluticasone par rapport à un traitement par CSI sans propionate de fluticasone et de 1,2 (IC 95 % ; 0,7 – 2,0) pour les femmes présentant un asthme important à sévère. Aucune différence dans le risque de MCM n’a été identifiée suite à l’exposition au propionate de fluticasone en monothérapie pendant le premier trimestre de la grossesse par rapport à l’association propionate de fluticasone/salmétérol. Les risques absolus de MCM quel que soit le degré de sévérité de l’asthme se situaient entre 2,0 et 2,9 pour 100 grossesses exposées au propionate de fluticasone, ce qui est comparable aux résultats d’une étude portant sur 15 840 grossesses non exposées à un traitement de l’asthme d’après la « General Practice Research Database » (2,8 MCMs pour 100 grossesses).
5.2. Propriétés pharmacocinétiques 
La pharmacocinétique de chaque constituant peut être considérée séparément.
Salmétérol
Le salmétérol agissant localement au niveau pulmonaire, les taux plasmatiques ne sont pas corrélés à l’effet thérapeutique. De plus, peu de données sont disponibles sur la pharmacocinétique du salmétérol après administration par voie inhalée car les concentrations plasmatiques observées aux doses thérapeutiques sont très faibles (au maximum 200 picogrammes/mL), et difficilement mesurables.
Propionate de fluticasone
La biodisponibilité absolue après administration d’une dose unique de propionate de fluticasone inhalé chez les volontaires sains varie approximativement de 5 à 11 % de la dose nominale selon le dispositif d’inhalation utilisé. Une moindre exposition systémique au propionate de fluticasone a été observée chez les patients asthmatiques.
Absorption
L’absorption est essentiellement pulmonaire. Elle est rapide dans un premier temps puis se poursuit plus lentement. Le reste de la dose inhalée peut être dégluti, mais ne contribue qu’en faible partie à l’exposition systémique du fait d’une faible solubilité aqueuse et d’un important métabolisme de premier passage. La biodisponibilité orale est ainsi inférieure à 1 %. L’exposition systémique augmente de façon linéaire avec l’augmentation de la dose inhalée.
Distribution
La distribution du propionate de fluticasone est caractérisée par une forte clairance plasmatique (1 150 mL/min), un important volume de distribution à l’état d’équilibre (environ 300 L) et une demi-vie terminale d’environ 8 heures. La liaison aux protéines plasmatiques est de 91 %.
Biotransformation
Le propionate de fluticasone est éliminé très rapidement de la circulation systémique. Le produit est essentiellement métabolisé en un dérivé acide carboxylique inactif, par l’isoenzyme CYP3A4 du cytochrome P450. D’autres métabolites non identifiés sont également retrouvés dans les fèces.
Elimination
La clairance rénale du propionate de fluticasone est négligeable. Moins de 5 % de la dose est excrétée dans les urines, principalement sous forme de métabolites. La majorité de la dose est éliminée dans les fèces sous forme de métabolites et sous forme inchangée.
Population pédiatrique
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n'est pas indiqué chez les enfants âgés de moins de 12 ans. Les études décrites ci-dessous ont été réalisées avec un produit préalablement autorisé ; les études décrites n'ont pas été réalisées avec PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER.
Dans une analyse pharmacocinétique de population regroupant les données de 9 études cliniques contrôlées conduites avec différents dispositifs d’inhalation (inhalateur de poudre sèche, aérosol-doseur) et incluant 350 patients atteints d'asthme âgés de 4 à 77 ans (dont 174 patients âgés de 4 à 11 ans), l'exposition systémique au propionate de fluticasone après traitement par inhalateur de poudre sèche fluticasone/salmétérol 100/50 était plus élevée par rapport à celui avec l’inhalateur de poudre sèche propionate de fluticasone 100.
Rapport de la moyenne géométrique [IC 90 %] de l’ASC et de la Cmax pour l’inhalateur de poudre sèche propionate de fluticasone/salmétérol par rapport à l’inhalateur de poudre sèche propionate de fluticasone. Comparaison dans la population enfant par rapport à la population adulte/adolescent.
|
Traitement (testé par rapport à la référence) |
Population |
ASC |
Cmax |
|
Inhalateur de poudre sèche propionate de fluticasone/salmétérol 100/50 Inhalateur de poudre sèche propionate de fluticasone 100 |
Enfants (4 –11 ans) |
1,20 [1,06 – 1,37] |
1,25 [1,11 – 1,41] |
|
Inhalateur de poudre sèche propionate de fluticasone/salmétérol 100/50 Inhalateur de poudre sèche propionate de fluticasone 100 |
Adolescent/Adulte |
1,52 [1,08 – 2,13] |
1,52 [1,08 – 2,16] |
L'effet de 21 jours de traitement par suspension pour inhalation en flacon pressurisé 25/50 microgrammes (2 inhalations deux fois par jour avec ou sans chambre d’inhalation) ou par inhalateur de poudre sèche fluticasone/salmétérol 100/50 microgrammes (1 inhalation deux fois par jour) a été évalué chez 31 enfants âgés de 4 à 11 ans ayant un asthme léger. L'exposition systémique au salmétérol était similaire pour la suspension pour inhalation en flacon pressurisé, l’inhalateur de poudre sèche fluticasone/salmétérol (126 picogrammes/h/mL [IC 95 % : 70 ; 225], 103 picogrammes/ h/mL [IC 95 % : 54 ; 200]) et 110 picogrammes/h/mL [IC 95 % : 55 ; 219] respectivement. L'exposition systémique au propionate de fluticasone était similaire pour la suspension pour inhalation en flacon pressurisé avec chambre d’inhalation (107 picogrammes/h/mL [IC 95 % : 45,7 ; 252,2]) et pour l’inhalateur de poudre sèche fluticasone/salmétérol (138 picogrammes/h/mL [IC 95 % : 69,3 ; 273,2]), mais plus faible pour la suspension pour inhalation en flacon pressurisé (24 picogrammes/h/mL [IC 95 % : 9,6 ; 60,2]).
5.3. Données de sécurité préclinique 
Au cours des études de reproduction menées chez l’animal, des malformations ont été observées après administration de glucocorticoïdes (fentes palatines, malformations osseuses). Cependant, ces résultats expérimentaux observés chez l’animal ne semblent pas prédictifs d’un effet malformatif chez l’homme aux doses recommandées. Les études menées chez l’animal avec le salmétérol ont montré une toxicité embryofoetale seulement après exposition à de fortes doses.
Après administration concomitante des deux principes actifs, il a été observé chez des rats recevant des doses de glucocorticoïdes connues pour induire des anomalies, une augmentation de la fréquence d’apparition de transposition de l’artère ombilicale et d’ossifications incomplètes au niveau de l’occipital. Ni le xinafoate de salmétérol ni le propionate de fluticasone n’ont montré d’effet potentiel en termes de toxicité génétique.
Lactose monohydraté (contenant des protéines de lait).
6.4. Précautions particulières de conservation 
À conserver à une température ne dépassant pas 30°C.
À conserver dans l’emballage d'origine à l’abri de l'humidité.
6.5. Nature et contenu de l'emballage extérieur 
La poudre pour inhalation est contenue dans une plaquette maintenue sur une base revêtue d’aluminium/OPA/PVC, avec un couvercle en pellicule laminée pelable PETP/papier/PVC. La bande est contenue dans un dispositif en plastique blanc moulé avec un capuchon coulissant rose clair, avec verrouillage de sécurité rouge.
L'inhalateur est emballé dans un sachet triple feuille d'aluminium composé d'un film polyester/ADH/aluminium/ADH/polyéthylène.
Les dispositifs en plastique sont disponibles dans des boîtes en carton contenant :
1 × 60 doses de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER
ou 2 × 60 doses de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER
ou 3 × 60 doses de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER
ou 10 × 60 doses de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Le PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER libère une poudre qui est inhalée dans les poumons. Sur le PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, un compteur de doses indique le nombre de prises restantes. Pour des informations détaillées, consulter la notice patient.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
26 AVENUE TONY GARNIER
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
ANSM - Mis à jour le : 08/03/2022
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/ 50 microgrammes/dose, poudre pour inhalation en récipient unidose
Propionate de fluticasone / Salmétérol
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
2. Quelles sont les informations à connaître avant d'utiliser PROPIONATE DE FLUTICASONE/ SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ?
3. Comment utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ?
6. Contenu de l'emballage et autres informations.
1. QU’EST-CE QUE PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ET DANS QUELS CAS EST-IL UTILISE ? 
Classe pharmacothérapeutique : adrénergiques en association avec des corticoïdes ou d'autres médicaments, à l'exclusion des anticholinergiques - code ATC : R03AK06.
· le salmétérol est un bêta-2 mimétique bronchodilatateur de longue durée d’action. Les bronchodilatateurs aident à garder les bronches ouvertes. Cela permet de faciliter l’entrée et la sortie de l’air dans les poumons. L’effet dure au moins 12 heures.
· le propionate de fluticasone est un corticoïde qui diminue l’inflammation et l’irritation dans les poumons.
Votre médecin vous a prescrit ce médicament pour aider à prévenir certains troubles respiratoires tels que l’asthme.
Vous devez utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER tous les jours comme indiqué par votre médecin. Cela permettra de contrôler correctement votre asthme.
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER permet d’éviter la survenue d’essoufflement et de sifflement. Cependant, PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ne doit pas être utilisé lorsque vous avez une crise soudaine d’essoufflement ou de sifflement. Dans ces cas, vous devez utiliser votre médicament bronchodilatateur dit « de secours » d’action rapide et de courte durée, comme le salbutamol. Vous devez toujours avoir sur vous votre inhalateur dit « de secours » d’action rapide et de courte durée.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ? 
· si vous êtes allergique au salmétérol, au propionate de fluticasone ou à l'autre composant de ce médicament, le lactose monohydraté, mentionnés dans la rubrique 6.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose si vous avez :
· une maladie du cœur, y compris un rythme cardiaque irrégulier ou trop rapide ;
· une hyperactivité de la thyroïde ;
· une pression artérielle élevée ;
· du diabète (PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut augmenter le taux de sucre dans votre sang) ;
· un faible taux de potassium dans votre sang ;
· une tuberculose actuellement en cours d’évolution ou survenue dans le passé, ou toute autre infection pulmonaire.
Contactez votre médecin en cas de vision floue ou d’autres troubles visuels.
Enfants
Ce médicament ne doit pas être utilisé chez les enfants âgés de moins de 12 ans.
Autres médicaments et PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament. Ceci est dû au fait que PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut ne pas être adapté à la prise simultanée d’autres médicaments.
Avant de commencer à utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, informez votre médecin si vous prenez un des médicaments suivants :
· bêta-bloquants (tels que aténolol, propranolol et sotalol). Les bêta-bloquants sont principalement utilisés dans le traitement de l'hypertension artérielle ou pour d'autres maladies cardiaques comme l’angine de poitrine ;
· médicaments utilisés pour traiter des infections (tels que le kétoconazole, l'itraconazole et l'érythromycine), y compris certains médicaments utilisés dans le traitement du VIH (tels que le ritonavir, les médicaments contenant du cobicistat). Certains de ces médicaments peuvent augmenter le taux de propionate de fluticasone ou de salmétérol dans votre organisme. Cela peut augmenter le risque d’avoir des effets indésirables avec PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, notamment des battements cardiaques irréguliers, ou d’aggraver les effets indésirables. Il se peut que votre médecin souhaite instaurer une surveillance particulière si vous prenez ces médicaments ;
· corticoïdes (par voie orale ou injectable). Si vous avez pris ces médicaments récemment, il existe un risque que ce médicament exerce également un effet sur les glandes surrénales de votre organisme ;
· diurétiques utilisés pour traiter l'hypertension artérielle ;
· autres bronchodilatateurs (comme le salbutamol) ;
· médicaments contenant de la xanthine, comme l’aminophylline et la théophylline. Ils sont souvent utilisés pour traiter l'asthme.
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/ 50 microgrammes/dose, poudre pour inhalation en récipient unidose avec des aliments et boissons
Sans objet.
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant d’utiliser ce médicament.
Conduite de véhicules et utilisation de machines
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER n’a pas de raison d’affecter la capacité à conduire un véhicule ou à utiliser une machine.
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose contient du lactose
PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER contient environ 13 milligrammes de lactose monohydraté par dose. Cette quantité ne cause généralement pas de problèmes chez les patients présentant une intolérance au lactose. L’excipient lactose contient de petites quantités de protéines de lait, qui peuvent provoquer des réactions allergiques.
3. COMMENT UTILISER PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ? 
· Utilisez PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER tous les jours, jusqu’à avis contraire de votre médecin. Ne prenez pas plus que la dose recommandée. En cas de doute, vérifiez auprès de votre médecin ou de votre pharmacien.
· N’arrêtez pas votre traitement ou ne réduisez pas vous-même vos doses de traitement sans en avoir préalablement parlé à votre médecin.
· PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER doit être inhalé par la bouche pour aller dans les poumons.
La dose recommandée est de :
Adultes et adolescents âgés de 12 ans et plus
Une inhalation deux fois par jour.
Vos symptômes doivent être bien contrôlés en utilisant PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER deux fois par jour. Si c’est le cas, votre médecin peut alors décider de réduire votre dose à une prise par jour.
Votre dose pourrait donc être réduite à :
· une prise le soir si vous avez des symptômes pendant la nuit,
ou
· une prise le matin si vous avez des symptômes pendant la journée.
Il est très important de suivre les indications données par votre médecin sur le nombre de bouffées à inhaler ou l’intervalle de temps entre chaque prise de votre médicament.
Si vous utilisez PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER pour le traitement de votre asthme, votre médecin souhaitera vérifier régulièrement votre état clinique.
Si votre asthme ou votre essoufflement s’aggrave, consultez votre médecin immédiatement. Si vous entendez des sifflements bronchiques plus importants, si vous vous sentez plus souvent oppressé au niveau de la poitrine ou si vous avez plus souvent besoin d’utiliser votre traitement bronchodilatateur de secours, continuez à utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sans augmenter le nombre de bouffées que vous prenez. Votre état respiratoire pourrait s’aggraver et vous pourriez alors être davantage malade. Dans ce cas, consultez votre médecin, car il se peut que vous ayez besoin d’un traitement supplémentaire.
Mode d'emploi
· PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut être différent des inhalateurs que vous avez utilisés dans le passé, il est donc très important que vous l'utilisiez correctement. Votre médecin, infirmier/ère ou pharmacien doivent vous apprendre à utiliser votre inhalateur. Cette formation est importante pour vous assurer de recevoir la dose dont vous avez besoin. Si vous n'avez pas encore suivi cette formation, veuillez demander à votre médecin, infirmier/ère ou pharmacien de vous montrer comment utiliser votre inhalateur correctement, surtout avant de l’utiliser pour la première fois. Ils devront vérifier régulièrement comment vous l'utilisez pour s’assurer que vous utilisez le dispositif correctement et conformément aux instructions. Ne pas utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER correctement ou comme vous l’a prescrit votre médecin pourrait limiter son efficacité pour traiter votre asthme ;
· Le dispositif porte des blisters contenant du propionate de fluticasone/salmétérol sous forme de poudre ;
· Un compteur de doses, positionné sur le dessus du dispositif, indique le nombre de doses restantes. Il décompte jusqu’à 0. Les chiffres 5 à 0 apparaîtront en rouge pour vous avertir qu’il vous reste peu de doses. Lorsque le compteur indique 0, votre inhalateur est vide.
Utilisation de l'inhalateur
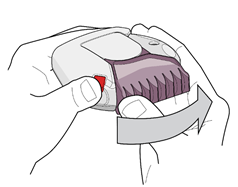
1. Pour ouvrir votre inhalateur, tenez-le d’une main et placez-le à plat. Appuyez sur le bouton rouge avec le pouce (voir la figure 1) et faites pivoter le couvercle de l’embout buccal rose clair vers l'arrière à l’aide du pouce de l’autre main en le maintenant éloigné de vous et aussi loin que possible jusqu’à entendre un « clic » (voir la figure 2). Cette action permet d’ouvrir un petit orifice au niveau de l’embout buccal et une dose de votre médicament est alors positionnée dans l’embout buccal.
|
|
|
|
Figure 1 |
Figure 2 |
Notez que chaque fois que l’embout buccal est ouvert avec un « clic », un blister est ouvert dans le dispositif et une nouvelle dose est prête à être inhalée ; par conséquent, n’ouvrez pas inutilement le couvercle de l’embout buccal car les doses ainsi libérées seraient perdues.
2. Eloignez l’inhalateur de la bouche, expirez autant que possible. Ne jamais souffler dans l’inhalateur.
3. Placez l’embout buccal entre les lèvres (voir la figure 3) ; inspirez régulièrement et profondément par la bouche à travers l’inhalateur, et non par le nez.
Retirez l’inhalateur de la bouche.
Retenez votre respiration pendant environ 10 secondes ou aussi longtemps que vous le pouvez.
Expirez lentement.
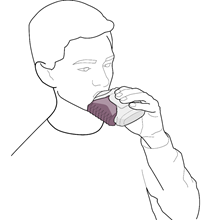
Figure 3
L'inhalateur délivre votre dose de médicament sous forme de poudre très fine. Vous pouvez ou non goûter ou sentir la poudre. N'utilisez pas de dose supplémentaire de l'inhalateur si vous ne sentez ni ne goûtez le médicament.
4. Fermez l'inhalateur pour maintenir sa propreté en faisant pivoter le couvercle de l’embout buccal rose clair vers vous, aussi loin que possible. Vous entendrez un « clic » (voir la figure 4). Le couvercle de l’embout buccal a été remis dans sa position initiale et réinitialisé. L'inhalateur est maintenant prêt afin que vous puissiez prendre votre prochaine dose programmée.
5. Ensuite, rincez votre bouche avec de l’eau et crachez-la et/ou brossez-vous les dents. Cela peut éviter l’apparition d’une candidose ou d’une raucité dans la voix.
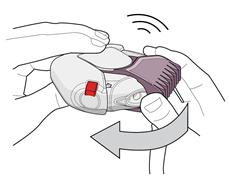
Nettoyage de l'inhalateur
Maintenez l’inhalateur propre et sec.
Si nécessaire, essuyez l’embout buccal de l’inhalateur avec un chiffon ou un mouchoir propre et sec.
Si vous avez utilisé plus de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose que vous n'auriez dû
Il est important d’utiliser le dispositif comme votre médecin vous l’a montré. Si vous avez pris accidentellement plus de doses que recommandé, parlez-en à votre médecin ou à votre pharmacien. Vous pouvez remarquer une accélération du rythme cardiaque et des tremblements. Vous pouvez également ressentir des vertiges, des maux de tête, une faiblesse musculaire, et des douleurs articulaires.
Si vous avez pris des doses plus importantes de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER pendant une longue période, vous devez en parler à votre médecin ou à votre pharmacien. Ceci parce que des doses élevées de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peuvent entraîner une diminution des hormones stéroïdiennes sécrétées par les glandes surrénales.
Si vous oubliez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose
Ne prenez pas de dose double pour compenser la dose que vous avez oublié de prendre. Prenez juste la dose suivante à l’heure habituelle.
Si vous arrêtez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose
Il est très important que vous preniez PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER tous les jours comme indiqué par votre médecin. Continuez votre traitement jusqu’à l’avis contraire de votre médecin. N’arrêtez pas ou ne réduisez pas les doses de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER subitement. Cela pourrait rendre votre respiration plus difficile.
De plus, si vous arrêtez brusquement l'utilisation de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER ou en réduisez brusquement la posologie, cela peut (très rarement) provoquer des problèmes des glandes surrénales (insuffisance surrénalienne) qui peuvent parfois entraîner des effets indésirables.
Ces effets indésirables peuvent notamment être les suivants :
· douleurs d’estomac,
· fatigue et perte d'appétit, nausées,
· vomissements et diarrhée,
· perte de poids,
· maux de tête ou somnolence,
· diminution du taux sanguin de sucre,
· baisse de tension artérielle et convulsions (crises d’épilepsie).
L’insuffisance surrénalienne peut s’aggraver et vous pouvez présenter un des effets indésirables mentionnés ci-dessus lorsque votre corps est soumis à des facteurs de stress tels que de l’apparition de fièvre ou un traumatisme (comme un accident de voiture), une infection ou une intervention chirurgicale.
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Pour éviter l'apparition de ces symptômes, votre médecin peut vous prescrire un traitement supplémentaire par corticoïdes sous forme de comprimé (tel que la prednisolone).
Si vous avez d'autres questions sur l'utilisation de ce médicament, demandez plus d'informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? 
Afin de réduire le risque d'effets indésirables, votre médecin prescrira la dose la plus faible possible de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER permettant de contrôler votre asthme.
Réactions allergiques : vous pouvez constater que votre essoufflement s’aggrave subitement, immédiatement après avoir utilisé PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER. Vous pouvez percevoir des sifflements bronchiques et tousser ou être essoufflé. Vous pouvez également ressentir des démangeaisons, remarquer une éruption cutanée (urticaire) ou un gonflement (généralement au niveau du visage, des lèvres, de la langue ou de la gorge), sentir que votre cœur se met soudainement à battre très rapidement ou vous sentir mal et avoir la tête qui tourne (malaise pouvant aller jusqu’à un évanouissement ou une perte de connaissance). Si vous ressentez l’un de ces symptômes ou s’ils apparaissent subitement après avoir utilisé PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER, arrêtez de prendre PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER et parlez-en à votre médecin immédiatement. Les réactions allergiques à PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sont peu fréquentes (elles affectent moins de 1 personne sur 100).
Effets très fréquents (peuvent affecter plus d’1 personne sur 10) :
· maux de tête diminuant généralement à la poursuite du traitement.
Effets fréquents (peuvent affecter jusqu'à 1 personne sur 10) :
· candidose de la bouche et de la gorge (parfois douloureuse). Également langue irritée, voix rauque et irritation de la gorge. Rincer votre bouche avec de l’eau et la cracher et/ou brossez-vous les dents immédiatement après chaque prise de votre médicament peut permettre d’éviter ces effets. Votre médecin peut vous prescrire un traitement antifongique pour soigner la candidose ;
· douleurs et inflammations des articulations, douleurs musculaires ;
· crampes musculaires.
Effets peu fréquents (peuvent affecter jusqu'à 1 personne sur 100) :
· augmentation du taux de sucre (glucose) dans le sang (hyperglycémie). Si vous avez du diabète, des contrôles plus fréquents de votre taux de sucre dans le sang et un ajustement possible de votre traitement antidiabétique peuvent être nécessaires ;
· cataracte (opacification du cristallin de l'œil) ;
· accélération rapide du rythme cardiaque (tachycardie) ;
· tremblements et rythme cardiaque rapide ou irrégulier (palpitations). Cela est généralement sans gravité et diminue à la poursuite du traitement ;
· douleur thoracique ;
· sentiment d’inquiétude (cet effet survient principalement chez les enfants) ;
· troubles du sommeil ;
· éruption cutanée allergique.
Effets rares (peuvent affecter jusqu'à 1 personne sur 1 000) :
· survenue brutale d’une difficulté à respirer ou de sifflements bronchiques juste après la prise de PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER. Dans ce cas, arrêtez d'utiliser PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER. Utilisez votre médicament bronchodilatateur dit « de secours » pour vous aider à respirer et prévenez votre médecin immédiatement ;
· PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER peut affecter la production normale d'hormones stéroïdiennes par l'organisme, particulièrement si vous avez pris des doses élevées et sur de longues périodes. Les effets incluent :
o un ralentissement de la croissance de l’enfant et de l’adolescent ;
o un amincissement de la trame osseuse ;
o un glaucome (affection de l'œil liée à une augmentation de la pression intraoculaire) ;
o une prise de poids ;
o un arrondissement (aspect en forme de lune) du visage (Syndrome de Cushing).
Votre médecin s’assurera régulièrement que vous ne présentez pas ces effets indésirables, et que vous utilisez cette association de médicaments à la plus faible dose permettant de contrôler votre asthme ;
· modifications du comportement, comme une activité et une irritabilité inhabituelles (bien que ces effets surviennent principalement chez les enfants) ;
· irrégularité du rythme cardiaque ou extrasystoles (arythmies). Prévenez votre médecin, mais n'arrêtez pas de prendre PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER sauf si votre médecin vous demande de l’arrêter ;
· une infection fongique de l'œsophage (tube digestif) qui peut causer des difficultés pour avaler.
Effets de fréquence indéterminée, mais pouvant également survenir :
· dépression ou agressivité. Ces effets sont plus susceptibles de survenir chez les enfants ;
· vision floue.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose ? 
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
À conserver à une température ne dépassant pas 30 °C.
Ne jetez aucun médicament au tout-à-l'égout ou avec les ordures ménagères. Demandez à votre pharmacien d'éliminer les médicaments que vous n'utilisez plus. Ces mesures contribueront à protéger l'environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS 
Ce que contient PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose 
· Les substances actives sont :
Propionate de fluticasone.............................................................................. 100 microgrammes
Salmétérol...................................................................................................... 50 microgrammes
Sous forme de xinafoate de salmétérol
Pour une dose mesurée.
Soit
Propionate de fluticasone................................................................................ 92 microgrammes
Salmétérol...................................................................................................... 47 microgrammes
Sous forme de xinafoate de salmétérol
Pour une dose délivrée à chaque inhalation (au niveau de l’embout buccal).
· L’autre composant est : le lactose monohydraté (qui contient des protéines de lait).
Qu’est-ce que PROPIONATE DE FLUTICASONE/SALMETEROL ARROW AIRMASTER 100 microgrammes/50 microgrammes/dose, poudre pour inhalation en récipient unidose et contenu de l’emballage extérieur 
Chaque dose est pré-mesurée.
Les dispositifs en plastique blanc avec un embout buccal dont le couvercle est rose clair sont conditionnés dans des boîtes contenant :
1, 2, 3 ou 10 inhalateurs contenant chacun 60 doses.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
26 AVENUE TONY GARNIER
69007 LYON
Exploitant de l’autorisation de mise sur le marché 
26 AVENUE TONY GARNIER
69007 LYON
VOLTTIKATU 5, VOLTTIKATU 8
KUOPIO, 70700
finlande
ou
APL Swift Services (Malta) Limited
HF26, Hal Far Industrial Estate, Hal Far
Birzebbugia, BBG 3000
Malte
OU
SPECIAL PRODUCT’S LINE S.P.A.
VIA FRATTA ROTONDA VADO LARGO, 1
03012 – ANAGNI (FR)
ITALY
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[À compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
{mois AAAA}.
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).