Gefitinib Arrow
Dosage: 250mg

Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Si vous prenez actuellement ce médicament, il vous est recommandé d'en parler avec votre médecin ou avec votre pharmacien qui pourra vous orienter vers un autre traitement.
Indications thérapeutiques
GEFITINIB ARROW contient la substance active géfitinib qui bloque une protéine appelée « récepteur du facteur de croissance épidermique » (EGFR). Cette protéine est impliquée dans la croissance et la dissémination des cellules cancéreuses.
GEFITINIB ARROW est utilisé pour traiter chez les adultes le cancer du poumon non à petites cellules. Ce cancer est une maladie au cours de laquelle des cellules malignes (cancer) se développent dans les tissus pulmonaires.
Groupe(s) générique(s)
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
Composition en substances actives
-
 Comprimé (Composition pour un comprimé)
Comprimé (Composition pour un comprimé)
-
> géfitinib
 250 mg
250 mg
-
> géfitinib
Présentations
> 30 plaquette(s) aluminium OPA : polyamide orienté PVC de 1 comprimé(s)
Code CIP : 34009 301 550 0 4Déclaration d'arrêt de commercialisation : 17/01/2023
Cette présentation n'est pas agréée aux collectivités
Taux de remboursement : 100%
Service médical rendu (SMR) 
Ce médicament étant un générique, le SMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Amélioration du service médical rendu (ASMR) 
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations (cliquer pour afficher)
- Titulaire de l'autorisation : ARROW GENERIQUES
-
Conditions de prescription et de délivrance :
- liste I
- médicament nécessitant une surveillance particulière pendant le traitement
- prescription hospitalière
- prescription réservée aux médecins compétents en CANCEROLOGIE
- prescription réservée aux spécialistes et services HEMATOLOGIE
- prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE
- Statut de l'autorisation : Valide
- Type de procédure : Procédure décentralisée
- Code CIS : 6 772 596 3
ANSM - Mis à jour le : 02/07/2021
GEFITINIB ARROW 250 mg, comprimé pelliculé
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Pour un comprimé pelliculé.
Excipient à effet notoire : chaque comprimé contient 163,5 mg de lactose (sous forme monohydratée).
Pour la liste complète des excipients, voir rubrique 6.1.
Les comprimés sont bruns, ronds, biconvexes, gravés « 250 » sur une face et lisses sur l’autre face. Le diamètre des comprimés pelliculés est de 11,1 mm.
4.1. Indications thérapeutiques 
4.2. Posologie et mode d'administration 
Posologie
La posologie recommandée de GEFITINIB ARROW est d’un comprimé de 250 mg une fois par jour. Si une dose a été oubliée, elle doit être prise aussitôt que le patient s’en souvient. S’il reste moins de 12 heures avant la prise de la prochaine dose, le patient ne doit pas prendre la dose oubliée. Les patients ne doivent pas prendre une double dose (deux doses en même temps) pour compenser une dose oubliée.
Population pédiatrique
La sécurité et l’efficacité du géfitinib n’ont pas été établies chez les enfants et chez les adolescents âgés de moins de 18 ans. Il n’y a pas d’utilisation justifiée du géfitinib dans l’indication du CBNPC dans la population pédiatrique.
Insuffisance hépatique
Les patients avec une insuffisance hépatique modérée à sévère (Child-Pugh B ou C) suite à une cirrhose ont une augmentation des concentrations plasmatiques du géfitinib. Une surveillance étroite des effets indésirables chez ces patients doit être effectuée. Les concentrations plasmatiques ne sont pas augmentées chez les patients qui ont une élévation de l’aspartate aminotransférase (ASAT), des phosphatases alcalines ou de la bilirubine liées à des métastases hépatiques (voir rubrique 5.2).
Insuffisance rénale
Aucun ajustement de dose n’est nécessaire chez les patients ayant une insuffisance rénale avec une clairance de la créatinine > 20 ml/min. Des données limitées sont disponibles chez les patients avec une clairance de la créatinine ≤ 20 ml/min et une attention est requise chez ces patients (voir rubrique 5.2).
Patients âgés
Aucun ajustement de dose n’est nécessaire en fonction de l’âge des patients (voir rubrique 5.2).
CYP2D6 métaboliseurs lents
Aucun ajustement spécifique de dose n’est recommandé chez les patients avec un génotype CYP2D6 métaboliseurs lents connus, mais une surveillance étroite des effets indésirables chez ces patients doit être effectuée (voir rubrique 5.2).
Ajustement de la dose en fonction de la toxicité
Les patients présentant une diarrhée mal tolérée ou des réactions indésirables cutanées, peuvent être pris en charge efficacement par une courte interruption du traitement (jusqu’à 14 jours) suivie de sa reprise à la dose de 250 mg (voir rubrique 4.8). Pour les patients ne supportant pas le traitement après une interruption de la thérapie, le géfitinib doit être arrêté et un traitement alternatif doit être envisagé.
Mode d’administration
Le comprimé peut être pris par voie orale avec ou sans aliment, chaque jour, approximativement vers la même heure. Le comprimé peut être entièrement avalé avec un peu d’eau ou si l’administration des comprimés entiers n’est pas possible, les comprimés peuvent être administrés après dispersion dans l’eau (non pétillante). Aucune autre boisson ne doit être utilisée. Sans l’écraser, le comprimé doit être mis dans un demi-verre d’eau. Le verre doit être remué de temps en temps jusqu’à dissolution du comprimé (cela peut prendre jusqu’à 20 minutes). La dispersion doit être bue immédiatement après dissolution totale (i.e. avant 60 minutes). Le verre doit être rincé avec un demi-verre d’eau qui doit aussi être bu. La dispersion peut être également administrée par sonde naso-gastrique ou par sonde de gastrostomie.
Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
Allaitement (voir rubrique 4.6).
4.4. Mises en garde spéciales et précautions d'emploi 
Seul(s) un/des test(s) robuste(s), fiable(s) et sensible(s), ayant démontré son/leur habilité à déterminer le statut de la mutation de l’EGFR au sein la tumeur ou de l’ADNct, doi(ven)t être utilisé(s) pour éviter les déterminations de faux négatifs ou de faux positifs (voir rubrique 5.1).
Affections pulmonaires interstitielles (API)
Des affections pulmonaires interstitielles (API), qui peuvent être aiguës dès le début, ont été observées chez 1,3 % des patients traités par le géfitinib ; certains cas ont eu une évolution fatale (voir rubrique 4.8). Si les patients présentent une aggravation des symptômes respiratoires, tels que dyspnée, toux et fièvre, le traitement par géfitinib doit être interrompu et le patient doit être examiné rapidement. En cas de confirmation d’une API, le traitement par géfitinib doit être arrêté et le patient pris en charge de manière appropriée.
Dans une étude pharmaco-épidémiologique japonaise cas-témoins chez 3159 patients ayant un CBNPC, sous géfitinib ou chimiothérapie, et suivis jusqu’à douze semaines, les facteurs de risque de survenue d’une API suivants (indépendamment du fait que le patient ait reçu du géfitinib ou une chimiothérapie) ont été identifiés : tabagisme, indice de performance faible (PS ≥ 2), des preuves scannographiques de la diminution de la surface pulmonaire saine (≤ 50 %), diagnostic récent de CBNPC (< 6 mois), pneumopathie interstitielle pré-existante, âge (≥ 55 ans) et pathologie cardiaque associée. Une augmentation du risque d’API sous géfitinib par rapport à la chimiothérapie a été principalement observée durant les 4 premières semaines de traitement (OR ajusté 3,8 ; 95 % IC 1,9 à 7,7) ; au-delà le risque relatif était plus faible (OR ajusté 2,5 ; 95 % IC 1,1 à 5,8). Sous géfitinib ou chimiothérapie, le risque de mortalité chez les patients ayant développé une API est plus élevé chez les patients présentant les facteurs de risque suivants : tabagisme, preuves scannographiques de la diminution de la surface pulmonaire saine (≤ 50 %), API pré-existante, âge (≥ 65 ans), et des zones étendues adhérentes à la plèvre (≥ 50 %).
Hépatotoxicité et insuffisance hépatique
Des anomalies du bilan hépatique (incluant des augmentations de l’alanine aminotransférase, de l’aspartate aminotransférase, de la bilirubine) ont été observées, se présentant peu fréquemment sous forme d’hépatite (voir rubrique 4.8). Il y a eu des cas isolés d’insuffisance hépatique qui ont, dans certains cas, conduit à une issue fatale. En conséquence, une surveillance régulière du bilan hépatique est recommandée. Le géfitinib devra être utilisé avec prudence en présence de modifications légères à modérées de la fonction hépatique. L’arrêt du traitement devra être envisagé en cas de modifications sévères.
Il a été observé qu’une insuffisance hépatique liée à une cirrhose entraînait une augmentation des concentrations plasmatiques de géfitinib (voir rubrique 5.2).
Interactions avec d’autres médicaments
Les inducteurs du CYP3A4 peuvent augmenter le métabolisme du géfitinib et réduire les concentrations plasmatiques du géfitinib. Par conséquent, la prise concomitante d’inducteurs du CYP3A4 (par exemple phénytoïne, carbamazépine, rifampicine, barbituriques ou préparations à base de plantes contenant du millepertuis/Hypericum perforatum) peut diminuer l’efficacité du traitement et doit être évitée (voir rubrique 4.5).
Chez les patients avec un génotype CYP2D6 métaboliseur lent, un traitement avec un inhibiteur puissant du CYP3A4 peut entraîner une augmentation de la concentration plasmatique du géfitinib. A l’initiation d’un traitement par un inhibiteur du CYP3A4, la survenue d’effets indésirables chez ces patients doit être étroitement surveillée (voir rubrique 4.5).
Une élévation de l’INR (International Normalised Ratio) et/ou des épisodes hémorragiques ont été rapportés chez certains patients traités par la warfarine en association avec le géfitinib (voir rubrique 4.5). Chez les patients traités simultanément par la warfarine et le géfitinib, le temps de prothrombine (TP) ou l’INR doivent être régulièrement contrôlés.
Les médicaments qui entraînent une augmentation significative et durable du pH gastrique tels que les inhibiteurs de la pompe à protons et les antagonistes des récepteurs H2 peuvent réduire la biodisponibilité et les concentrations plasmatiques du géfitinib et par conséquent en diminuer l’efficacité. Les anti-acides pris régulièrement dans un intervalle de temps rapproché avec l’administration de géfitinib peuvent avoir un effet similaire (voir rubriques 4.5 et 5.2).
Les données des essais cliniques de phase II, avec utilisation concomitante du géfitinib et de vinorelbine, montrent que le géfitinib pourrait augmenter l’effet neutropéniant de la vinorelbine.
Précautions d’emploi complémentaires
Il faut recommander aux patients de demander immédiatement un avis médical s’ils développent une diarrhée sévère ou persistante, des nausées, des vomissements ou une anorexie qui pourraient indirectement entraîner une déshydratation. Ces symptômes doivent être pris en charge selon l’état clinique (voir rubrique 4.8).
Les patients présentant des signes et symptômes aigus ou d’aggravation suggestifs d’une kératite tels que : inflammation de l’œil, larmoiement, sensibilité à la lumière, vision trouble, douleur oculaire et/ou un œil rouge doivent être immédiatement adressés à un ophtalmologiste.
Si un diagnostic de kératite ulcérative est confirmé, le traitement par le géfitinib doit être interrompu, et si les symptômes ne se résolvent pas ou si les symptômes réapparaissent à la réintroduction du géfitinib, un arrêt définitif devra être envisagé.
Dans un essai de phase I/II évaluant l’utilisation du géfitinib et de la radiothérapie dans une population pédiatrique, avec des patients nouvellement diagnostiqués avec une tumeur gliale cérébrale ou une tumeur gliale supratentorielle incomplètement réséquée, 4 cas (1 fatal) d’hémorragie du Système Nerveux Central (SNC) ont été rapportés parmi 45 enfants inclus. Dans le cadre d’un essai clinique avec géfitinib en monothérapie, un autre cas d’hémorragie du SNC a été observé chez un enfant souffrant d’un épendymome. Une augmentation du risque d’hémorragie cérébrale chez les patients adultes présentant un CBNPC et recevant du géfitinib n’a pas été établie.
Des perforations gastro-intestinales ont été rapportées chez des patients prenant du géfitinib. Dans la plupart des cas, elles étaient associées à d’autres facteurs de risque connus, incluant l’administration concomitante de médicaments tels que des stéroïdes ou des AINS, des antécédents d'ulcères gastro-intestinaux, l’âge, le tabagisme ou des métastases intestinales au niveau de la perforation.
Excipients
GEFITINIB ARROW contient du lactose monohydraté. Les patients présentant une intolérance au galactose, un déficit total en lactase ou un syndrome de malabsorption du glucose et du galactose (maladies héréditaires rares) ne doivent pas prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c’est-à-dire qu’il est essentiellement « sans sodium ».
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Substances actives pouvant augmenter les concentrations plasmatiques du géfitinib
Les études in vitro ont montré que le géfitinib est un substrat de la p-glycoprotéine (P-gp). Les données disponibles ne suggèrent pas d’impact clinique de ce résultat in vitro.
Les substances qui inhibent le CYP3A4 peuvent diminuer la clairance du géfitinib. L’administration concomitante avec des inhibiteurs puissants de l’activité du CYP3A4 (exemple : kétoconazole, posaconazole, voriconazole, inhibiteurs de protéase, clarithromycine, télithromycine) peut augmenter les concentrations plasmatiques du géfitinib. L’augmentation peut avoir un effet clinique significatif puisque les effets indésirables sont liés à la dose et à la durée d’exposition. L’augmentation peut être plus élevée chez les patients avec un génotype métaboliseur lent du CYP2D6. Un traitement préalable avec l’itraconazole (un inhibiteur puissant du CYP3A4) entraîne une augmentation de 80 % de l’aire sous la courbe moyenne du géfitinib chez les volontaires sains. Dans les situations d’un traitement concomitant avec des inhibiteurs puissants du CYP3A4, le patient doit être surveillé étroitement pour les effets indésirables du géfitinib.
Il n’existe aucune donnée concernant un traitement concomitant avec un inhibiteur du CYP2D6, mais les inhibiteurs puissants de cette enzyme peuvent entraîner une augmentation d’environ 2 fois des concentrations plasmatiques du géfitinib chez les métaboliseurs rapides du CYP2D6 (voir rubrique 5.2). Si un traitement concomitant avec un inhibiteur puissant du CYP2D6 est initié, le patient doit être surveillé étroitement pour les effets indésirables.
Substances actives pouvant diminuer les concentrations plasmatiques du géfitinib
Les substances qui ont une activité inductrice du CYP3A4 peuvent augmenter le métabolisme et diminuer les concentrations plasmatiques du géfitinib et par conséquent diminuer l’efficacité du géfitinib. Un traitement concomitant inducteur du CYP3A4 (exemple : phénytoïne, carbamazépine, rifampicine, barbituriques ou millepertuis (Hypericum perforatum)) doit être évité. Un traitement préalable avec la rifampicine (un inducteur puissant du CYP3A4) a entraîné une réduction de 83 % de l’aire sous la courbe moyenne chez les volontaires sains (voir rubrique 4.4).
Les substances qui entraînent une augmentation significative et durable du pH gastrique peuvent diminuer les concentrations plasmatiques du géfitinib et par conséquent diminuer l’efficacité du géfitinib. De fortes doses d’anti-acides à courte durée d’action pourraient entraîner le même effet si pris régulièrement dans un intervalle de temps rapproché avec l’administration de géfitinib. L’administration concomitante du géfitinib avec la ranitidine à une dose provoquant une élévation du pH gastrique ≥ 5 a entraîné une diminution de l’aire sous la courbe moyenne de 47 % du géfitinib chez les volontaires sains (voir rubriques 4.4 et 5.2).
Substances actives pouvant avoir leurs concentrations plasmatiques altérées par le géfitinib
Des études in vitro ont montré que le géfitinib a un potentiel limité à inhiber le CYP2D6. Lors d’une étude clinique réalisée chez des patients, le géfitinib a été co-administré avec le métoprolol (substrat du CYP2D6). Cela a résulté en une augmentation de 35 % de l’exposition au métoprolol. Une telle augmentation pourrait potentiellement être significative pour les substrats du CYP2D6 avec un index thérapeutique étroit. Lorsque l’utilisation des substrats du CYP2D6 est envisagée en association avec le géfitinib, une modification de la dose du substrat du CYP2D6 doit être envisagée en particulier pour les produits présentant une fenêtre thérapeutique étroite.
In vitro, le géfitinib inhibe la protéine de transport BCRP, mais la signification clinique de ce résultat est inconnue.
Autres interactions potentielles
Une augmentation de l’INR et/ou des épisodes hémorragiques ont été décrits chez certains patients prenant de façon concomitante de la warfarine (voir rubrique 4.4).
4.6. Fertilité, grossesse et allaitement 
Femmes en âge de procréer
Les femmes en âge de procréer doivent être incitées à ne pas être enceintes pendant le traitement.
Grossesse
Il n’existe pas de données relatives à l’utilisation du géfitinib chez la femme enceinte. Des études chez l’animal ont mis en évidence une toxicité sur la fonction de reproduction (voir rubrique 5.3). Le risque potentiel chez l’être humain est inconnu. GEFITINIB ARROW ne doit pas être utilisé pendant la grossesse sauf si indispensable.
Le passage de géfitinib dans le lait maternel est inconnu. Le géfitinib et ses métabolites s’accumulent dans le lait maternel chez la rate allaitante (voir rubrique 5.3). Le géfitinib est contre-indiqué en cas d’allaitement ; de ce fait, l’allaitement doit être arrêté pendant le traitement par le géfitinib (voir rubrique 4.3).
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Résumé du profil de sécurité d’emploi
Dans les données poolées des études cliniques de phase III ISEL, INTEREST et IPASS (2462 patients traités par géfitinib) les effets indésirables (EI) les plus fréquemment rapportés, survenant chez plus de 20 % des patients, sont une diarrhée et des réactions cutanées (incluant éruption cutanée, acné, sécheresse cutanée et prurit). Les effets indésirables se manifestent habituellement au cours du premier mois de traitement et sont généralement réversibles. Environ 8 % des patients ont développé un effet indésirable sévère (Common Toxicity Criteria (CTC), grade 3 ou 4). Environ 3 % des patients ont arrêté le traitement suite à un effet indésirable.
Des affections pulmonaires interstitielles (API) sont survenues chez 1,3 % des patients, souvent sévères (CTC grade 3-4). Des cas avec évolution fatale ont été rapportés.
Liste tabulée des effets indésirables
Le profil de tolérance présenté dans le tableau 1 est issu du programme de développement clinique du géfitinib et de l’expérience après commercialisation. Les effets indésirables ont été classés par catégories de fréquence dans le tableau 1 dans la mesure du possible sur la base de l’incidence d’effets indésirables comparables rapportés dans la base de données regroupant les essais cliniques de phase III ISEL, INTEREST et IPASS (2462 patients traités par géfitinib).
Les fréquences d’apparition des effets indésirables sont définies comme suit :
Très fréquent (≥1/10) ; fréquent (de ≥1/100 à <1/10) ; peu fréquent (de ≥1/1 000 à <1/100) ; rare (de ≥1/10 000 à <1/1 000) ; très rare (<1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Au sein de chaque groupe de fréquence, les effets indésirables sont présentés suivant un ordre décroissant de gravité.
Tableau 1 : Effets indésirables
|
Effets indésirables par classes de systèmes d’organes et fréquence |
||
|
Troubles du métabolisme et de la nutrition |
Très fréquents |
Anorexie, légère ou modérée (CTC grade 1 ou 2). |
|
Affections oculaires |
Fréquents |
Conjonctivite, blépharite et sécheresse oculaire*, généralement d’intensité légère (CTC grade 1). |
|
Peu fréquents |
Érosion de la cornée, réversible et parfois associée à une pousse aberrante des cils. Kératite (0,12%) |
|
|
Affections vasculaires |
Fréquents |
Hémorragie, tels qu’épistaxis et hématurie. |
|
Affections respiratoires, thoraciques et médiastinales |
Fréquents |
Affections pulmonaires interstitielles (1,3 %), souvent sévères (CTC grade 3-4). Des cas d’évolution fatale ont été rapportés. |
|
Affections gastro-intestinales |
Très fréquents |
Diarrhée, généralement légère ou modérée (CTC grade 1 ou 2). Vomissements, généralement d’intensité légère ou modérée (CTC grade 1 ou 2). Nausées, généralement d’intensité légère (CTC grade 1). Stomatite, essentiellement d’intensité légère (CTC grade 1). |
|
Fréquents |
Déshydratation, secondaire à des diarrhées, nausées, vomissements ou anorexie. Bouche sèche*, essentiellement d’intensité légère (CTC grade 1). |
|
|
Peu fréquents |
Pancréatite. Perforation gastro-intestinale. |
|
|
Affections hépatobiliaires |
Très fréquents |
Augmentations de l’alanine aminotransférase (ALAT), essentiellement légères à modérées. |
|
Fréquents |
Augmentations de l’aspartate aminotransférase (ASAT), essentiellement légères à modérées. Augmentations de la bilirubine totale, essentiellement légères à modérées. |
|
|
Peu fréquents |
Hépatite**. |
|
|
Affections de la peau et du tissu sous-cutané |
Très fréquents |
Réactions cutanées, généralement une éruption pustuleuse légère ou modérée (CTC grade 1 ou 2), parfois démangeaisons avec sécheresse cutanée, incluant des fissures, sur une base érythémateuse |
|
Fréquents |
Affections unguéales. Alopécie. Réactions allergiques (1,1%), incluant des angioœdèmes et de l’urticaire. |
|
|
Peu fréquents |
Syndrome d’érythrodysethésie palmo-plantaire |
|
|
Rares |
Eruptions bulleuses incluant nécrolyse épidermique toxique, syndrome de Stevens Johnson et érythème polymorphe. Vascularite cutanée. |
|
|
Affections du rein et des voies urinaires |
Fréquents |
Augmentation asymptomatique de la créatininémie Protéinurie Cystite |
|
Rares |
Cystite hémorragique |
|
|
Troubles généraux et anomalies au site d’administration |
Très fréquents |
Asthénie, essentiellement légère (CTC grade 1). |
|
Fréquents |
Fièvre |
|
La fréquence des effets indésirables liée à des anomalies biologiques est basée sur la modification de 2 ou plus du grade CTC par rapport à la valeur initiale des patients d’après les normes du laboratoire.
* Cet effet indésirable peut être associé à d’autres situations cliniques à type de sécheresse (principalement des réactions cutanées) observées sous géfitinib.
** Cela inclut des cas isolés d’insuffisance hépatique qui ont, dans certains cas, conduit à une issue fatale.
Affections pulmonaires interstitielles (API)
Dans l’étude INTEREST, l’incidence rapportée des événements de type API était de 1,4 % (10 patients) dans le groupe géfitinib versus 1,1 % (8 patients) dans le groupe docétaxel. Un événement de type API a eu une issue fatale chez un patient ayant reçu du géfitinib.
Dans l’étude ISEL l’incidence des événements de type API dans la population globale de l’étude était approximativement de 1 % dans les deux bras de traitement. La majorité des événements de type API a été rapportée chez des patients d’origine asiatique et l’incidence des API chez ces patients recevant du géfitinib ou placebo, étaient d’environ 3 % et 4 % respectivement. Un événement de type affection pulmonaire interstitielle d’évolution fatale est survenue chez un patient sous placebo.
Dans une étude japonaise de surveillance post-commercialisation (3350 patients), le taux rapporté des événements de type affection pulmonaire interstitielle a été de 5,8 % chez des patients recevant du géfitinib. La proportion des événements de type API avec issue fatale étaient de 38,6 %.
Dans une étude clinique de phase III en ouvert (IPASS) chez 1217 patients, comparant le géfitinib à une double chimiothérapie par carboplatine/paclitaxel en première ligne de traitement chez des patients avec un cancer bronchique avancé non à petites cellules en Asie, l’incidence des événements de type API a été de 2,6 % dans le bras géfitinib versus 1,4 % dans le bras carboplatine/paclitaxel.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Il n’existe pas de traitement spécifique en cas de surdosage du géfitinib. Toutefois, lors d’essais cliniques de phase I, un nombre limité de patients a reçu des doses journalières pouvant atteindre 1000 mg. Il a été observé une augmentation de la fréquence et de la sévérité de certains effets indésirables, essentiellement de la diarrhée et de l’éruption cutanée. Les effets indésirables associés à un surdosage devront être traités symptomatiquement, en particulier la diarrhée sévère sera prise en charge en fonction des signes cliniques. Dans une étude, un nombre limité de patients ont été traités hebdomadairement avec des doses de 1500 mg à 3500 mg. Dans cette étude, l’exposition au géfitinib n’a pas augmenté avec l’augmentation de la dose, les événements indésirables étaient pour la plupart d’intensité légère à modérée, et étaient en accord avec le profil de sécurité connu du géfitinib.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action et effets pharmacodynamiques
Le facteur de croissance épidermique (EGF) et son récepteur (EGFR [HER1; ErbB1]) ont été identifiés comme des facteurs importants dans le processus de croissance cellulaire et de prolifération des cellules normales et cancéreuses. La mutation activatrice de l’EGFR dans une cellule cancéreuse est un facteur important dans la croissance de la cellule tumorale en bloquant l’apoptose, en augmentant la production de facteurs angiogéniques et en facilitant les processus de métastases.
Le géfitinib est une petite molécule inhibitrice sélective de la tyrosine kinase du récepteur du facteur de croissance épidermique et est un traitement efficace pour les patients ayant une tumeur avec mutations activatrices de la tyrosine kinase de l’EGFR quelle que soit la ligne de traitement. Aucune activité clinique significative n’a été montrée chez les patients ayant une tumeur sans mutation de l’EGFR.
Les mutations activatrices de l'EGFR les plus fréquentes (délétions dans l’exon 19 ; L858R) confèrent des données de réponses robustes étayant la sensibilité au géfitinib ; par exemple une survie sans progression HR (IC à 95 %) de 0,489 (0,336 ; 0,710) pour le géfitinib versus doublet de chimiothérapie [WJTOG3405]. Les données de réponse du géfitinib sont plus rares chez les patients dont les tumeurs présentent les mutations les moins fréquentes ; les données disponibles indiquent que les mutations G719X, L861Q et S7681 ont un effet sensibilisant ; et que la mutation T790M seule ou des insertions dans l’exon 20 seules sont des mécanismes de résistance.
Résistance
Dans le CBNPC, la plupart des tumeurs qui présentent des mutations EGFR kinase activatrices vont développer une résistance au traitement par géfitinib, avec un temps médian jusqu’à progression de la maladie d’une durée d’un an. Dans environ 60 % des cas, la résistance est associée à l’apparition d’une mutation secondaire : T790M pour laquelle un traitement par les ITKs EGFR ciblant cette mutation peut être envisagé comme possibilité de ligne de traitement suivante. Les autres mécanismes potentiels de résistance qui ont été rapportés après le traitement par des inhibiteurs de tyrosine kinases de l’EGFR incluent : contournement du signal telles que les amplifications de gène HER2 et MET et les mutations PIK3CA. Un changement phénotypique en cancer du poumon à petites cellules a aussi été rapporté dans 5 à 10 % des cas.
ADN tumoral circulant (ADNct)
Dans l’étude IFUM, le statut de la mutation a été évalué sur des échantillons de tumeur et d’ADNct obtenus à partir du plasma, en utilisant le kit TheraScreen EGFR RGQ PCR (Qiagen). Des échantillons provenant à la fois d’ADNct et de tumeur ont été analysables pour 652 patients sur les 1060 sélectionnés. Le taux de réponse objective (RO) chez les patients pour lesquels la mutation était positive dans la tumeur et dans l’ADNct était de 77 % (IC à 95 % : 66 % à 86 %) et chez ceux dont seule la mutation dans la tumeur était positive, le taux de RO était de 60 % (IC à 95 % : 44 % à 74 %).
Tableau 2 : Résumé du statut initial de la mutation pour les échantillons de tumeur et d’ADNct chez tous les patients sélectionnés pour lesquels les deux échantillons étaient analysables.
|
Mesure |
Définition |
Taux IFUM (IC) % |
IFUM N |
|
Sensibilité |
Proportion de tumeur M+ qui sont M+ par ADNct |
65,7 (55,8 ; 74,7) |
105 |
|
Spécificité |
Proportion de tumeur M- qui sont M- par ADNct |
99,8 (99,0 ; 100,0) |
547 |
Ces données sont cohérentes avec l’analyse exploratoire prévue dans les sous-groupes de patients Japonais dans l’étude IPASS (Goto 2012). Dans cette étude, l’ADNct obtenu à partir du sérum, et non à partir du plasma, a été utilisé pour l’analyse de la mutation de l'EGFR à l'aide du kit EGFR Mutation Test (DxS) (N=86). Dans cette étude, la sensibilité était de 43,1 %, et la spécificité de 100 %.
Efficacité et sécurité cliniques
Première ligne de traitement
L’étude clinique IPASS de phase III en première ligne, randomisée, a été réalisée en Asie1 chez des patients présentant un CBNPC avancé (stade IIIB ou IV), avec une histologie de type adénocarcinome, anciens fumeurs légers (arrêt ≥ 15 ans et moins de 10 paquets-années) ou non-fumeurs (voir tableau 3).
1 Chine, Hong Kong, Indonésie, Japon, Malaisie, Philippines, Singapour, Taïwan et Thaïlande.
Tableau 3 : Résultats d’efficacité du géfitinib versus carboplatine/paclitaxel dans l’étude IPASS
|
Population |
N |
Taux de réponse objective et IC à 95 % de la différence entre les traitementsa |
Critère principal Survie sans progression (SSP) a,b |
Survie globale a,b |
|
Totale |
1217 |
43.0% vs 32.2% [5.3% ; 16.1%] |
HR 0.74 [0.65 ; 0.85] 5.7 m vs 5.8 m p<0.0001 |
HR 0.90 [0.79 ; 1.02] 18.8 m vs 17. 4m p=0.1087 |
|
EGFR muté
|
261 |
71.2% vs 47.3% [12.0% ; 34.9%] |
HR 0.48 [0.36 ; 0.64] 9.5 m vs 6.3 m p<0.0001 |
HR 1.00 [0.76 ; 1.33] 21.6 m vs 21.9 m |
|
EGFR non-muté
|
176 |
1.1% vs 23.5% [-32.5% ; -13.3%] |
HR 2.85 [2.05 ; 3.98] 1.5 m vs 5.5 m p<0.0001 |
HR 1.18 [0.86 ; 1.63] 11.2 m vs 12.7 m |
|
EGFR mutation inconnue
|
780 |
43.3% vs 29.2% [7.3% ; 20.6%] |
HR 0.68 [0.58 à 0.81] 6.6 m vs 5.8 m p<0.0001 |
HR 0.82 [0.70 à 0.96] 18.9 m vs. 17.2 m |
a Les données fournies comparent géfitinib à carboplatine/paclitaxel.
b “m” correspond à la médiane en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 95 %
N Nombre de patients randomisés.
HR Hazard ratio (hazard ratios <1 en faveur du géfitinib)
Les résultats de qualité de vie diffèrent selon le statut de la mutation de l’EGFR. Chez les patients avec mutation de l’EGFR, les patients traités par géfitinib ont une amélioration significative de la qualité de vie et des symptômes du cancer pulmonaire versus carboplatine/paclitaxel (voir tableau 4).
Tableau 4 : Résultats de qualité de vie pour le géfitinib versus carboplatine/paclitaxel dans l’étude IPASS
|
Population |
N |
FACT-L QdV Taux d'améliorationa % |
LCS Taux d'amélioration des symptômesa % |
|
Totale |
1151 |
(48.0% vs 40.8%) p=0.0148 |
(51.5% vs 48.5%) p=0.3037 |
|
EGFR muté
|
259 |
(70.2% vs 44.5%) p<0.0001 |
(75.6% vs 53.9%) p=0.0003 |
|
EGFR non-muté
|
169 |
(14.6% vs 36.3%) p=0.0021 |
(20.2% vs 47.5%) p=0.0002 |
Les résultats de l’index TOI (Trial Outcome Index) étaient en cohérence avec les données du FACT-L et du LCS
a Les données fournies comparent géfitinib à carboplatine/paclitaxel
N Nombre de patients évaluables pour les analyses de la qualité de vie
QdV Qualité de vie
FACT-L (Functional Assessment of Cancer Therapy-Lung) Évaluation fonctionnelle dans le traitement du cancer du poumon
LCS (Lung Cancer Subscale) Échelle d’évaluation du cancer du poumon
Dans l’étude IPASS, le géfitinib a démontré une supériorité sur la SSP, le taux de RO, la QdV et le soulagement symptomatique sans différence significative pour la survie globale par rapport au carboplatine/paclitaxel chez des patients non préalablement traités, présentant un CBNPC localement avancé ou métastatique, dont les tumeurs présentaient des mutations activatrices de la tyrosine kinase de l’EGFR.
Patients préalablement traités
L’étude clinique randomisée de phase III INTEREST a été conduite chez des patients présentant un cancer bronchique non à petites cellules localement avancé ou métastatique et ayant reçu préalablement une chimiothérapie à base de sels de platine. Dans la population totale, aucune différence statistiquement significative n’a été observée entre le géfitinib et le docétaxel (75 mg/m2) pour la survie globale, la survie sans progression et le taux de réponse objective (voir tableau 5).
Tableau 5 : Résultats d’efficacité pour le géfitinib versus docétaxel dans l’étude INTEREST
|
Population |
N |
Taux de réponse objective et IC à 95 % de la différence entre les traitementsa |
Survie sans progressionab |
Critère principal survie globaleab |
|
Totale |
1466 |
9.1% vs 7.6% [-1.5% ; 4.5%] |
HR 1.04 [0.93 ;1.18] 2.2 m vs 2.7 m p=0.4658 |
HR 1.020 [0.905 ; 1.150] c 7.6 m vs 8.0 m p=0.7332 |
|
EGFR muté
|
44 |
42.1% vs 21.1% [-8.2% ; 46.0%] |
HR 0.16 [0.05 ; 0.49] 7.0 m vs 4.1 m p=0.0012 |
HR 0.83 [0.41 ; 1.67] 14.2 m vs 16.6 m p=0.6043 |
|
EGFR non-muté
|
253 |
6.6% vs 9.8% [-10.5% ; 4.4%] |
HR 1.24 [0.94 ;1.64] 1.7 m vs 2.6 m p=0.1353 |
HR 1.02 [0.78 ; 1.33] 6.4 m vs 6.0 m p=0.9131 |
|
Asiatiques c
|
323 |
19.7% vs 8.7% [3.1 % ; 19.2 %] |
HR 0.83 [0.64 ; 1.08] 2.9 m vs 2.8 m p=0.1746 |
HR 1.04 [0.80 ; 1.35] 10.4 m vs 12.2 m p=0.7711 |
|
Non-asiatiques |
1143 |
6.2% vs 7.3% [-4.3% ; 2.0%] |
HR 1.12 [0.98 ; 1.28] 2.0 m vs 2.7 m p=0.1041 |
HR 1.01 [0.89 ; 1.14] 6.9 m vs 6.9 m p=0.9259 |
a Les données fournies comparent géfitinib à docétaxel.
b “m” correspond aux médianes en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 96 % pour la survie globale de la population totale ou sinon un HR avec un intervalle de confiance à 95 % pour les autres paramètres.
c Intervalle de confiance intégralement en dessous de la borne de non infériorité de 1,154
N Nombre de patients randomisés.
HR Hazard ratio (hazard ratios <1 en faveur du géfitinib)
Figures 1 et 2 : Résultats d’efficacité du sous-groupe des patients non asiatiques dans l’étude IINTEREST (N patients = Nombre de patients randomisés)
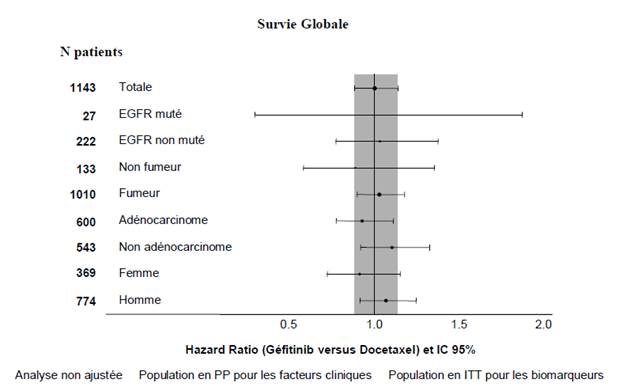
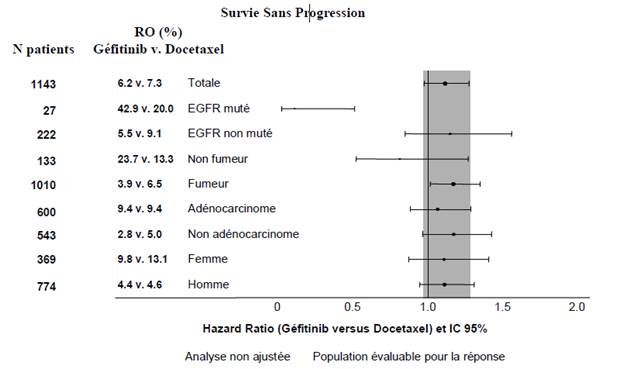
L’étude clinique randomisée de phase III ISEL a été réalisée chez des patients ayant un CBNPC à un stade avancé qui avaient reçu préalablement une ou plusieurs lignes de chimiothérapie et étaient réfractaires ou intolérants à leur dernier traitement. Le géfitinib plus traitement symptomatique optimal (Best Supportive Care) a été comparé au placebo plus traitement symptomatique optimal. Le géfitinib n’a pas prolongé la survie dans la population globale. Les résultats de survie diffèrent suivant le statut fumeur et l’origine ethnique (voir tableau 6).
Tableau 6 : Résultats d’efficacité pour le géfitinib versus placebo dans l’étude ISEL
|
Population |
N |
Taux de réponse objective et IC à 95 % de la différence entre les traitementsa |
Temps jusqu'à échec du traitementab |
Critère principal survie globaleabc |
|
Totale |
1692 |
8.0% vs 1.3% [4.7% ; 8.8%] |
HR 0.82 [0.73 ; 0.92] 3.0 m vs 2.6 m p=0.0006 |
HR 0.89 [0.77 ;1.02] 5.6 m vs 5.1 m p=0.0871 |
|
EGFR muté
|
26 |
37.5% vs 0% [-15.1% ; 61.4%] |
HR 0.79 [0.20 ; 3.12] 10.8 m vs 3.8m p=0.7382 |
HR NC
NA vs 4.3 m |
|
EGFR non-muté
|
189 |
2.6% vs 0% [-5.6% ; 7.3%] |
HR 1.10 [0.78 ; 1.56] 2.0 m vs 2.6 m p=0.5771 |
HR 1.16 [0.79 ; 1.72] 3.7 m vs 5.9 m p=0.4449 |
|
Non-fumeur |
375 |
18.1% vs 0% [12.3 % ; 24.0 %] |
HR 0.55 [0.42 ; 0.72] 5.6 m vs 2.8 m p<0.0001 |
HR 0.67 [0.49 ; 0.92] 8.9 m vs 6.1 m p=0.0124 |
|
Fumeur |
1317 |
5.3% vs 1.6% [1.4% ; 5.7%] |
HR 0.89 [0.78 ; 1.01] 2.7 m vs 2.6 m p=0.0707 |
HR 0.92 [0.79 ; 1.06] 5.0 m vs 4.9 m p=0.2420 |
|
Asiatique d
|
342 |
12.4% vs 2.1% [4.0 % ; 15.8 %] |
HR 0.69 [0.52 ; 0.91] 4.4 m vs 2.2 m p=0.0084 |
HR 0.66 [0.48 ; 0.91] 9.5 m vs 5.5 m p=0.0100 |
|
Non-asiatique |
1350 |
6.8% vs 1.0% [3.5% ; 7.9%] |
HR 0.86 [0.76 ; 0.98] 2.9 m vs 2.7 m p=0.0197 |
HR 0.92 [0.80 ; 1.07] 5.2 m vs 5.1 m p=0.2942 |
a Les données fournies comparent le géfitinib au placebo.
b “m” correspond aux médianes en mois. Les chiffres entre crochets représentent un HR avec un intervalle de confiance à 95
c Test du log-rank stratifié pour la population totale, sinon utilisation du modèle de cox à hasards proportionnels
d L’origine asiatique exclut les patients d’origine indienne et se base sur l’origine raciale d’un groupe de patients et non nécessairement son lieu de naissance
N Nombre de patients randomisés.
NC Non calculé – pour le HR de la survie globale si le nombre d’événements est trop faible
NA Non atteint
HR Hazard ratio (hazard ratios <1 en faveur du géfitinib)
L’étude IFUM était une étude à bras unique, multicentrique, menée chez des patients caucasiens (n=106) présentant un CBNPC avec mutations activatrices de l’EGFR, ayant pour but de confirmer que l’activité du géfitinib est similaire dans les populations caucasiennes et asiatiques. Le taux de RO, basé sur l’évaluation de l’investigateur, était de 70% et la médiane de survie sans progression était de 9,7 mois. Ces résultats sont similaires à ceux rapportés dans l’étude IPASS.
Statut de la mutation de l’EGFR et caractéristiques cliniques
Les caractéristiques cliniques du patient telles que le statut non-fumeur, une histologie de type adénocarcinome et le sexe féminin, sont des facteurs prédictifs indépendants de la présence d’une mutation de l’EGFR dans une analyse multivariée chez 786 patients caucasiens à partir des études réalisées avec le géfitinib* (voir tableau 7). Les patients asiatiques ont aussi une incidence plus élevée de tumeurs avec une mutation de l’EGFR.
Tableau 7 : Résumé de l’analyse multivariée par régression logistique pour l’identification des facteurs prédictifs indépendants de la présence de la mutation de l’EGFR chez 786 patients caucasiens*
|
Facteurs prédictifs de la présence de la mutation EGFR |
Valeur de p |
Odds Ratio de la présence de la mutation EGFR |
Valeur prédictive (9,5 % de la population totale présente la mutation de l’EGFR (M+)) |
|
Tabagisme |
<0,0001 |
6,5 fois plus élevé chez les non-fumeurs que chez les fumeurs |
28/70 (40%) des non-fumeurs sont mutés (M+) 47/716 (7%) des fumeurs sont mutés (M+) |
|
Histologie |
<0,0001 |
4,4 fois plus élevé chez les adénocarcinomes que chez les non-adénocarcinomes |
63/396 (16%) des patients avec une histologie de type adénocarcinome sont mutés (M+) 12/390 (3%) des patients avec une histologie de type non-adénocarcinome sont mutés (M+) |
|
Sexe |
0,0397 |
1,7 fois plus élevé chez les femmes que chez les hommes |
40/235 (17%) des femmes sont mutées (M+) 35/551 (6%) des hommes sont mutés (M+) |
*à partir des études suivantes : INTEREST, ISEL, INTACT 1&2, IDEAL 1&2, INVITE
5.2. Propriétés pharmacocinétiques 
Après administration orale du géfitinib, l’absorption est modérément lente et le pic des concentrations plasmatiques de géfitinib est généralement atteint en 3 à 7 heures. La biodisponibilité absolue moyenne est de 59 % chez les patients cancéreux. La prise de nourriture est sans effet significatif sur l’exposition au géfitinib. Dans un essai réalisé auprès de volontaires sains dont le pH gastrique a été maintenu au-dessus de 5, l’exposition au géfitinib a été réduite de 47 %, vraisemblablement liée à une solubilité réduite du géfitinib dans l’estomac (voir rubriques 4.4 et 4.5).
Distribution
Le géfitinib présente un volume de distribution moyen à l’équilibre de 1400 L, témoignant d’une diffusion tissulaire importante. La fixation aux protéines plasmatiques est de l’ordre de 90 %. Le géfitinib se lie à l’albumine sérique et à l’α1-glycoprotéine acide.
Les données in vitro montre que le géfitinib est un substrat de la protéine de transport membranaire Pg-p.
Biotransformation
Les données in vitro montrent que le CYP3A4 et le CYP2D6 sont les principaux iso-enzymes du cytochrome P450 impliqué dans le métabolisme oxydatif du géfitinib.
Les études in vitro ont montré que le géfitinib a un potentiel limité d’inhibition du CYP2D6. Le géfitinib n’a montré chez l’animal aucun effet d’induction enzymatique et aucune inhibition significative de toute autre enzyme du cytochrome P450 (in vitro).
Chez l’homme, le géfitinib est fortement métabolisé. Cinq métabolites ont été complètement identifiés dans les excrétions et 8 métabolites dans le plasma. Le métabolite principal identifié est l’O-desméthyl géfitinib dont le pouvoir inhibiteur de la prolifération cellulaire stimulée par l’EGFR s’avère 14 fois moins puissant que celui du géfitinib et il n’a pas d’effet inhibiteur sur la croissance de la cellule tumorale chez la souris. Par conséquent, sa contribution à l’activité clinique du géfitinib est donc peu probable.
Il a été montré in vitro que l’O-desméthyl géfitinib est produit via le CYP2D6. Le rôle du CYP2D6 dans la clairance métabolique du géfitinib a été évalué dans un essai clinique chez des volontaires sains génotypés pour le statut CYP2D6. Chez les métaboliseurs lents, il n’a pas été observé de production mesurable d’O-desméthyl géfitinib. Les spectres d’exposition du géfitinib obtenus à la fois chez les métaboliseurs lents et rapides étaient larges et se chevauchaient, mais la moyenne de l’exposition du géfitinib est 2 fois plus élevée dans le groupe des métaboliseurs lents. Les moyennes les plus hautes des expositions susceptibles d’être atteintes chez les patients sans activité du CYP 2D6 pourraient être cliniquement significatives, sachant que les effets indésirables dépendent de la dose et de l’exposition.
Élimination
Le géfitinib est principalement excrété sous forme de métabolites dans les fèces, avec une élimination rénale du géfitinib et de ses métabolites qui représente moins de 4 % de la dose administrée.
La clairance plasmatique totale du géfitinib est de l’ordre de 500 ml/min et la demi-vie terminale moyenne est de 41 heures chez les patients cancéreux. L’administration de géfitinib une fois par jour se traduit par une accumulation d’un facteur de 2 à 8 avec un état d’équilibre atteint après 7 à 10 doses. A l’état d’équilibre, les concentrations dans le plasma circulant se maintiennent dans les limites d’un facteur de 2 à 3 sur l’intervalle de 24 heures entre deux administrations.
Populations particulières
D’après les analyses de pharmacocinétique de données de population réalisées chez des patients cancéreux, aucune relation n’a été identifiée entre la concentration prévisible à l’équilibre et l’âge des patients, le poids, le sexe, l’origine ethnique ou la clairance de la créatinine (au-dessus de 20 ml/min).
Insuffisance hépatique
Dans une étude clinique de phase I, ouverte, à la dose unique de 250 mg de géfitinib, chez des patients présentant une insuffisance hépatique légère, modérée ou sévère liée à une cirrhose (suivant la classification de Child-Pugh), il y a eu une augmentation de l’exposition dans tous ces groupes par rapport au sujet sain. Chez les patients présentant une insuffisance hépatique modérée et sévère, une augmentation moyenne de 3,1 fois de l’exposition au géfitinib a été observée.
Aucun de ces patients n’avait un cancer, tous avaient une cirrhose et quelques-uns avaient une hépatite. Cette augmentation pourrait être cliniquement significative sachant que les effets indésirables dépendent de la dose et de l’exposition au géfitinib.
Le géfitinib a été évalué dans un essai clinique chez 41 patients présentant une tumeur solide, avec une fonction hépatique normale ou une insuffisance hépatique modérée ou sévère (classée selon le grade CTC à l’inclusion pour l’ASAT, les phosphatases alcalines et la bilirubine) due à des métastases hépatiques. Suite à une administration quotidienne de 250 mg de géfitinib, le temps d’atteinte à l’état d’équilibre, la clairance plasmatique totale (CmaxSS) et l’exposition à l’équilibre (ASC24SS) ont été similaires dans les groupes présentant une insuffisance hépatique modérée et une fonction hépatique normale. Les données de 4 patients avec une insuffisance hépatique sévère liée à la présence de métastases hépatiques suggèrent que les expositions à l’état d’équilibre sont également similaires à celles des patients à fonction hépatique normale.
5.3. Données de sécurité préclinique 
· atrophie de l’épithélium de la cornée et translucidité cornéale,
· nécrose papillaire rénale,
· nécrose hépatocellulaire et infiltration des sinusoïdes par des macrophages à coloration éosinophile.
Les données non cliniques (in vitro) indiquent que le géfitinib a un potentiel d’inhibition du processus de repolarisation du potentiel d’action cardiaque (par exemple l’intervalle QT). L’expérience clinique n’a pas montré de relation causale entre la prolongation du QT et le géfinitib.
Une diminution de la fertilité chez la rate a été observée à la dose de 20 mg/kg/jour.
Des études publiées ont montré que, chez les souris génétiquement modifiées, une absence d’expression de l’EGFR entraîne une anomalie du développement liée à une immaturité épithéliale sur une variété d’organes dont la peau, le tractus gastro-intestinal et les poumons.
Lors de l’administration du géfitinib au cours de l’organogénèse, il n’y a eu aucun effet sur le développement embryo-fœtal chez le rat à la plus haute dose (30 mg/kg/jour). Cependant chez le lapin, il y a eu une diminution des poids des fœtus à la dose de 20 mg/kg/jour et au-delà. Aucune malformation induite par le géfitinib n’a été rapportée chez les espèces étudiées. Lors de l’administration chez la rate au cours de la gestation et de la mise bas, il y a eu une diminution de la survie de la portée à la dose de 20 mg/kg/ jour.
Après administration orale du géfitinib marqué au C-14 à des rates allaitantes 14 jours post-partum, les concentrations de la radioactivité dans le lait étaient 11 à 19 fois plus élevées que dans le sang.
Le géfitinib n’a montré aucun potentiel génotoxique.
Une étude de carcinogénicité de 2 ans chez le rat a montré une petite mais significative augmentation de l’incidence des adénomes hépatocellulaires chez le rat mâle et femelle et des hémangiosarcomes des ganglions lymphatiques mésentériques chez la rate à la plus haute dose (10 mg/kg/jour) seulement. Les adénomes hépatocellulaires ont été également observés dans une étude de carcinogénicité de 2 ans chez la souris ; cette étude a montré une petite augmentation de l’incidence de ce résultat chez la souris mâle à la demi dose, et à la fois chez la souris mâle et femelle à la dose la plus élevée. Ces effets ont atteint le seuil de significativité chez la souris femelle mais non chez le mâle. Les doses sans effet utilisées chez la souris et le rat ne correspondaient pas aux doses utilisées en clinique. La signification clinique de ces observations est inconnue.
Les résultats d’une étude in vitro de phototoxicité ont montré que le géfitinib peut avoir un potentiel phototoxique.
Pelliculage : alcool polyvinylique (E1203), macrogol 3350 (E1521), talc (E553b), dioxyde de titane (E171), oxyde de fer rouge (E172), oxyde de fer jaune (E172)
4 ans.
6.4. Précautions particulières de conservation 
A conserver dans l’emballage d’origine, à l’abri de l’humidité.
6.5. Nature et contenu de l'emballage extérieur 
Boîte de 30 comprimés pelliculés sous plaquettes prédécoupées unitaires (Aluminium-OPA/Aluminium/PVC) ou plaquettes (Aluminium-OPA/Aluminium/PVC) non prédécoupées.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
26 AVENUE TONY GARNIER
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 34009 301 549 9 1 : comprimé sous plaquette (Aluminium-OPA/Aluminium/PVC). Boîte de 30
· 34009 301 550 0 4 : comprimé sous plaquette prédécoupée unitaire (Aluminium-OPA/Aluminium/PVC). Boîte de 30
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
Médicament nécessitant une surveillance particulière pendant le traitement.
Médicament soumis à prescription hospitalière.
Prescription réservée aux spécialistes en oncologie ou en hématologie ou aux médecins compétents en cancérologie.
ANSM - Mis à jour le : 02/07/2021
GEFITINIB ARROW 250 mg, comprimé pelliculé
Géfitinib
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que GEFITINIB ARROW 250 mg, comprimé pelliculé et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant de prendre GEFITINIB ARROW 250 mg, comprimé pelliculé ?
3. Comment prendre GEFITINIB ARROW 250 mg, comprimé pelliculé ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver GEFITINIB ARROW 250 mg, comprimé pelliculé ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE GEFITINIB ARROW 250 mg, comprimé pelliculé ET DANS QUELS CAS EST-IL UTILISE ? 
GEFITINIB ARROW contient la substance active géfitinib qui bloque une protéine appelée « récepteur du facteur de croissance épidermique » (EGFR). Cette protéine est impliquée dans la croissance et la dissémination des cellules cancéreuses.
GEFITINIB ARROW est utilisé pour traiter chez les adultes le cancer du poumon non à petites cellules. Ce cancer est une maladie au cours de laquelle des cellules malignes (cancer) se développent dans les tissus pulmonaires.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT DE PRENDRE GEFITINIB ARROW 250 mg, comprimé pelliculé ? 
Ne prenez jamais GEFITINIB ARROW 250 mg, comprimé pelliculé :
· si vous êtes allergique au géfitinib ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· si vous allaitez.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant de prendre GEFITINIB ARROW 250 mg, comprimé pelliculé :
· si vous avez déjà eu d’autres problèmes pulmonaires. Certains problèmes pulmonaires peuvent s’aggraver pendant le traitement par GEFITINIB ARROW ;
· si vous avez déjà eu des problèmes avec votre foie.
Enfants et adolescents
GEFITINIB ARROW n’est pas indiqué chez les enfants et les adolescents de moins de 18 ans.
Autres médicaments et GEFITINIB ARROW 250 mg, comprimé pelliculé
Informez votre médecin ou votre pharmacien si vous prenez, avez récemment pris, ou pourriez prendre tout autre médicament.
Votre médecin ou votre pharmacien doit en particulier savoir si vous prenez un des médicaments suivants :
· phénytoïne ou carbamazépine (pour l’épilepsie) ;
· rifampicine (pour la tuberculose) ;
· itraconazole (pour des affections fongiques) ;
· barbituriques (médicament utilisé pour des problèmes de sommeil) ;
· des remèdes à base de plantes contenant du Millepertuis (Hypericum perforatum, pour la dépression et l’anxiété) ;
· inhibiteurs de la pompe à protons, antagonistes des récepteurs H2 et antiacides (pour les ulcères, les indigestions, les brûlures d’estomac et pour diminuer l’acidité de l’estomac).
Ce médicament peut affecter l’activité de GEFITINIB ARROW :
· warfarine (un anticoagulant oral destiné à prévenir la formation de caillots sanguins). Si vous prenez un médicament contenant cette substance active, il se peut que votre médecin vous demande de faire plus souvent un examen sanguin.
Si l’une des situations ci-dessus vous concerne, ou si vous avez un doute, vérifiez avec votre médecin ou votre pharmacien avant de prendre GEFITINIB ARROW.
Grossesse, allaitement et fertilité
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin avant de prendre ce médicament. Il est recommandé que vous évitiez d’être enceinte pendant le traitement par GEFITINIB ARROW car GEFITINIB ARROW peut être dangereux pour votre bébé.
Ne prenez pas GEFITINIB ARROW si vous allaitez, il en va de la sécurité de votre bébé.
Conduite de véhicules et utilisation de machines
Vous pouvez ressentir des signes de faiblesse pendant votre traitement par GEFETINIB ARROW. Dans ce cas, ne conduisez pas de véhicules ou n’utilisez pas d’outils ou de machines.
GEFITINIB ARROW 250 mg, comprimé pelliculé contient du lactose et du sodium.
Si votre médecin vous a informé(e) d’une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
Ce médicament contient moins de 1 mmol (23 mg) de sodium par comprimé pelliculé, c’est-à-dire qu’il est essentiellement « sans sodium ».
3. COMMENT PRENDRE GEFITINIB ARROW 250 mg, comprimé pelliculé ? 
· La dose recommandée est d’un comprimé à 250 mg par jour.
· Prenez le comprimé chaque jour à peu près au même moment.
· Vous pouvez prendre le comprimé avec ou sans aliments.
· Ne prenez pas d’antiacides (pour diminuer le taux d’acidité de votre estomac) 2 heures avant ou dans l’heure qui suit la prise de GEFITINIB ARROW.
Si vous avez des difficultés à avaler le comprimé, il peut être dissout dans un demi-verre d’eau plate (non pétillante). Aucune autre boisson ne doit être utilisée. N’écrasez pas le comprimé. Remuez jusqu’à dissolution du comprimé. Cela peut prendre jusqu’à 20 minutes. Buvez le liquide en une fois.
Pour être sûr que vous avez bu tout le médicament, rincez correctement le verre avec un demi-verre d’eau et buvez-le.
Si vous avez pris plus de GEFITINIB ARROW 250 mg, comprimé pelliculé que vous n’auriez dû
Si vous avez pris plus de comprimés que vous n’auriez dû, avertissez aussitôt votre médecin ou votre pharmacien.
Si vous oubliez de prendre GEFITINIB ARROW 250 mg, comprimé pelliculé
· s’il reste 12 heures ou plus avant la prise de la dose suivante : prendre le comprimé que vous avez oublié dès que vous vous en rendez compte. Puis prendre la dose suivante comme prévu ;
· s’il reste moins de 12 heures avant la prise de la dose suivante : ne pas prendre le comprimé que vous avez oublié. Puis prendre le comprimé suivant comme prévu.
Ne prenez pas une double dose (deux comprimés en même temps) pour compenser la dose que vous avez oublié de prendre.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou à votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? 
Prenez immédiatement contact avec votre médecin si vous constatez l’un des effets indésirables suivants - vous pourriez avoir besoin d’un traitement médical en urgence :
· réactions allergiques (fréquentes), en particulier si les symptômes incluent un gonflement du
visage, des lèvres, de la langue ou de la gorge, des difficultés pour avaler, de l’urticaire et des difficultés pour respirer ;
· essoufflement important ou aggravation soudaine d’un essoufflement, éventuellement avec toux ou fièvre. Cela peut signifier que vous avez une inflammation des poumons, appelée « affection pulmonaire interstitielle ». Cela peut concerner environ 1 patient sur 100 prenant du géfitinib et peut mettre en danger votre vie ;
· réactions cutanées sévères (rares) s’étendant sur des surfaces importantes de votre corps. Les signes peuvent comprendre rougeur, douleur, ulcérations, cloques et décollement de la peau. Les lèvres, le nez, les yeux et les parties génitales peuvent aussi être atteints ;
· déshydratation (fréquente) suite à une diarrhée sévère ou persistante, des vomissements, des nausées (envie de vomir) ou une perte d’appétit ;
· troubles oculaires (peu fréquents), tels que douleur, rougeur, yeux larmoyants, sensibilité à la lumière, troubles de la vision ou pousse de cils incarnés. Ceci peut signifier que vous avez une ulcération de la surface de l’œil (cornée).
Si vous constatez l’un des effets indésirables suivants, informez-en votre médecin dès que possible :
Très fréquents (peuvent affecter plus de 1 personne sur 10) :
· diarrhée ;
· vomissements ;
· nausées ;
· réactions cutanées de type éruption acnéiforme, accompagnées parfois de démangeaisons avec sécheresse et/ou crevasse cutanée ;
· perte d’appétit ;
· faiblesse ;
· bouche rouge ou douloureuse ;
· augmentation d’une enzyme hépatique appelée alanine aminotransférase lors d’un bilan sanguin ; si les taux sont trop élevés, votre médecin peut être amené à arrêter GEFITINIB ARROW.
Fréquents (peuvent affecter jusqu’à 1 personne sur 10) :
· bouche sèche ;
· sécheresse oculaire, yeux rouges ou avec démangeaison ;
· paupières rouges et douloureuses ;
· problèmes au niveau des ongles ;
· perte de cheveux ;
· fièvre ;
· saignement (tel que saignement du nez ou sang dans vos urines) ;
· protéines dans vos urines (révélées par un test urinaire) ;
· augmentation de la bilirubine ou d’une autre enzyme hépatique appelée aspartate aminotransférase lors d’un bilan sanguin ; si les taux sont trop élevés, votre médecin peut être amené à arrêter GEFITINIB ARROW ;
· augmentation du taux de créatinine lors d’un bilan sanguin (en relation avec la fonction rénale) ;
· cystite (sensation de brûlure lors des mictions et besoin fréquent et urgent d’uriner).
Peu fréquents (peuvent affecter jusqu’à 1 personne sur 100) :
· inflammation du pancréas. Les signes comprennent une douleur très forte dans la partie haute de la zone de l’estomac, des nausées et des vomissements sévères ;
· inflammation du foie. Les symptômes peuvent inclure une sensation générale de malaise, avec ou sans jaunisse (coloration jaune de la peau et des yeux). Cet effet indésirable est peu fréquent, cependant certains patients en sont décédés ;
· perforation gastro-intestinale ;
· réaction cutanée au niveau des paumes des mains et des plantes des pieds incluant des picotements, de l’engourdissement, une douleur, un gonflement ou des rougeurs (connu sous le nom de syndrome d’érythrodysesthésie palmo-plantaire ou syndrome main-pied).
Rares (peuvent affecter jusqu’à 1 patient sur 1000) :
· inflammation des vaisseaux sanguins de la peau. Cela peut prendre l’apparence de bleus ou de zones d’éruptions cutanées dont la coloration ne disparaît pas à la pression ;
· cystite hémorragique (sensation de brûlure lors des mictions et besoin fréquent et urgent d’uriner avec présence de sang dans l’urine).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER GEFITINIB ARROW 250 mg, comprimé pelliculé ? 
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP. La date de péremption fait référence au dernier jour de ce mois.
A conserver dans l’emballage d'origine, à l’abri de l’humidité.
Ce médicament ne nécessite pas de précautions particulières de conservation concernant la température.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS 
Ce que contient GEFITINIB ARROW 250 mg, comprimé pelliculé 
· La substance active est :
Géfitinib......................................................................................................................... 250 mg
Pour un comprimé pelliculé.
· Les autres composants sont : lactose monohydraté, cellulose microcristalline (E460), croscarmellose sodique (E468), povidone K30 (E1201), stéarate de magnésium (E470b), laurilsulfate de sodium, alcool polyvinylique (E1203), macrogol 3350 (E1521), talc (E553b), dioxyde de titane (E171), oxyde de fer rouge (E172), oxyde de fer jaune (E172).
Qu’est-ce que GEFITINIB ARROW 250 mg, comprimé pelliculé et contenu de l’emballage extérieur 
GEFITINIB ARROW se présente sous la forme de comprimés bruns, ronds, gravés « 250 » sur une face et lisses sur l’autre face. Le diamètre des comprimés pelliculés est de 11,1 mm.
GEFITINIB ARROW est présenté en boite de 30 comprimés. La plaquette peut être prédécoupée unitaire ou non prédécoupée.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
26 AVENUE TONY GARNIER
69007 LYON
Exploitant de l’autorisation de mise sur le marché 
26 AVENUE TONY GARNIER
69007 LYON
AHARNON STREET
LIMASSOL INDUSTRIAL ESTATE
3056 LIMASSOL
CHYPRE
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Ce médicament est autorisé dans les Etats membres de l'Espace Economique Européen sous les noms suivants : Conformément à la réglementation en vigueur.
[à compléter ultérieurement par le titulaire]
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).




