Cefpodoxime Arrow for Infants and Children powder for oral suspension
PRODUCTS Antimicrobial Cefpodoxime Arrow for Infants and Children powder for oral suspensionCefpodoxime Arrow for Infants and Children powder for oral suspension
Dosage: 40mg/5mL
Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Indications thérapeutiques
Classe pharmacothérapeutique : antibactériens à usage systémique - code ATC : J01DD13
Ce médicament est un antibiotique antibactérien de la famille des bêta-lactamines.
Ce médicament est indiqué chez l’enfant dans le traitement de certaines infections bactériennes à germes sensibles.
Groupe(s) générique(s)
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
Composition en substances actives
-
 Poudre (Composition pour 5 mL de suspension reconstituée)
Poudre (Composition pour 5 mL de suspension reconstituée)
-
> cefpodoxime
 40 mg
40 mg
-
 sous forme de : cefpodoxime proxétil
sous forme de : cefpodoxime proxétil
-
-
> cefpodoxime
Présentations
> 1 flacon(s) en verre brun avec fermeture de sécurité enfant de 50 ml avec seringue(s) pour administration orale polyéthylène polypropylène
Code CIP : 387 500-6 ou 34009 387 500 6 5Déclaration de commercialisation : 05/06/2009
Cette présentation est agréée aux collectivités
Taux de remboursement : 65%
> 1 flacon(s) en verre brun avec fermeture de sécurité enfant de 100 ml avec seringue(s) pour administration orale polyéthylène polypropylène
Code CIP : 387 501-2 ou 34009 387 501 2 6Déclaration de commercialisation : 10/06/2009
Cette présentation est agréée aux collectivités
Taux de remboursement : 65%
Documents de bon usage du médicament
- Choix et durée de l'antibiothérapie : Rhinopharyngite aiguë enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Otite moyenne aiguë purulente de l’adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Sinusites de l'enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durées d'antibiothérapies : Angine aiguë de l’enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Rhinopharyngite aiguë enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Otite moyenne aiguë purulente de l’adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Sinusites de l'enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durées d'antibiothérapies : Angine aiguë de l’enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Rhinopharyngite aiguë l’adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Otite moyenne aiguë purulente de l’enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Sinusite de l'adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Rhinopharyngite aiguë l’adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Otite moyenne aiguë purulente de l’enfant
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
- Choix et durée de l'antibiothérapie : Sinusite de l'adulte
Auteur : Haute autorité de santé
Type : Fiche mémo
Date de mise à jour : Juillet 2024
Service médical rendu (SMR) 
Ce médicament étant un générique, le SMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Amélioration du service médical rendu (ASMR) 
Ce médicament étant un générique, l'ASMR n'a pas été évalué par la commission de la transparence (CT), il est possible de se référer à la /aux spécialité(s) de référence du groupe générique auquel appartient ce médicament (cliquez ici pour aller à la rubrique des groupes génériques)
Autres informations (cliquer pour afficher)
- Titulaire de l'autorisation : ARROW GENERIQUES
- Conditions de prescription et de délivrance :
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 793 298 3
ANSM - Mis à jour le : 17/09/2021
CEFPODOXIME ARROW ENFANTS ET NOURRISSONS 40 mg/5 ml, poudre pour suspension buvable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Cefpodoxime......................................................................................................................... 40 mg
Sous forme de Cefpodoxime proxétil
Pour 5 mL de suspension reconstituée.
Excipients à effet notoire : saccharose, aspartam (source de phénylalanine) (E951), sodium, benzoate de sodium (E211).
Pour la liste complète des excipients, voir rubrique 6.1.
4.1. Indications thérapeutiques 
Elles sont limitées chez l'enfant au traitement des infections dues aux germes sensibles au cefpodoxime, et notamment :
· Otites moyennes aiguës,
· Angines documentées à streptocoque A bêta-hémolytique,
· Sinusites,
· Infections respiratoires basses.
Il convient de tenir compte des recommandations officielles concernant l’utilisation appropriée des antibactériens.
4.2. Posologie et mode d'administration 
Posologie
Enfant normo-rénal
La posologie moyenne est de 8 mg/kg/jour, sans dépasser la dose adulte (200 mg/jour dans l’angine et 400 mg/jour dans les autres indications), répartis en 2 prises à 12 heures d’intervalle.
|
La dose par prise est indiquée, en fonction du poids de l’enfant, sur le manchon-réservoir de la cuillère-mesure, par les graduations correspondant au poids de l’enfant en kg (graduations de 5 à 25 kg). La dose par prise se lit donc directement. Ainsi, le point indiqué correspond à la dose pour une prise. La dose à administrer pour une prise est donc obtenue en tirant le manchon-réservoir jusqu’à la graduation correspondant au poids de l’enfant. Deux prises par jour sont nécessaires. Par exemple, la graduation n°12 correspond à la dose à administrer par prise pour un enfant de 12 kg, et ce, deux fois par jour. |
La durée de traitement des angines est de 5 jours.
Insuffisant rénal
Si la clairance de la créatinine est > 40 ml/min/1,73 m2, se référer à la posologie du sujet normo-rénal.
Si la clairance de la créatinine est < 40 ml/min/1,73 m2, voir le tableau ci-dessous :
|
Clairance de la créatinine (ml/min/1.73 m2) |
Doses |
|
10-39 |
Une dose unitaire toutes les 24 heures |
|
<10 |
Une dose unitaire toutes les 48 heures |
En cas d’hémodialyses, une dose unitaire sera administrée après chaque séance de dialyse.
Insuffisant hépatique
Il n’est pas nécessaire de modifier la posologie.
Mode d’administration
Voie orale.
La suspension buvable est à administrer au cours d’un repas.
Avant la mise en suspension, la capsule contenant le déshydratant, située à l’intérieur du bouchon, doit être retirée et jetée.
La poudre contenue dans le flacon est mise en suspension par addition d’eau au moment de l’emploi jusqu’au trait de jauge.
Le flacon doit être agité afin d’homogénéiser la suspension ainsi obtenue.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1 ;
· En cas d’allergie connue aux antibiotiques du groupe des céphalosporines.
· En raison de la présence d’aspartam, ce médicament est contre-indiqué en cas de phénylcétonurie.
4.4. Mises en garde spéciales et précautions d'emploi 
· La survenue de toute manifestation allergique impose l’arrêt du traitement ;
· La prescription de céphalosporines nécessite un interrogatoire préalable, l’allergie aux pénicillines étant croisée avec celle aux céphalosporines dans 5 à 10% des cas :
o l’utilisation des céphalosporines doit être extrêmement prudente chez les patients pénicillinosensibles : une surveillance médicale stricte est nécessaire dès la première administration ;
o l’emploi des céphalosporines est à proscrire formellement chez les sujets ayant des antécédents d’allergie de type immédiat aux céphalosporines. En cas de doute, la présence du médecin auprès du patient est indispensable à la première administration, afin de traiter l’accident anaphylactique possible ;
o les réactions d’hypersensibilité (anaphylaxie) observées avec ces deux types de bêta-lactamines peuvent être graves et parfois fatales.
· La survenue d’un épisode diarrhéique peut être symptomatique, de façon exceptionnelle, d’une colite pseudo-membraneuse dont le diagnostic repose sur la coloscopie.
· Cet accident, rare avec les céphalosporines, impose l’arrêt immédiat du traitement et la mise en route d’une antibiothérapie spécifique appropriée (vancomycine). Dans ce cas, l’administration de produits favorisant la stase fécale doit absolument être évitée.
· Affections hématologiques :
Comme pour les autres antibiotiques de la classe des bêta-lactamines, une neutropénie et plus rarement une agranulocytose peuvent se développer pendant le traitement avec cefpodoxime, notamment si le traitement est de longue durée. Dans ce cas, une surveillance hématologique doit être envisagée.
· Eruptions bulleuses :
Comme pour les autres céphalosporines, des cas d’éruptions bulleuses (érythème polymorphe, syndrome de Stevens-Johnson, syndrome de Lyell) ont été rapportés. Si une atteinte de la peau et/ou des muqueuses survient, les patients doivent immédiatement contacter leur médecin, et ce, avant de continuer le traitement.
· Surinfection :
Comme pour les autres antibiotiques, l’administration de cefpodoxime, notamment si le traitement est de longue durée, peut entraîner une croissance excessive des micro-organismes non sensibles. Des évaluations régulières de l’état du patient sont essentielles. Si une surinfection survient pendant le traitement, des mesures appropriées doivent être prises.
· Encéphalopathie :
Les bêta-lactamines incluant le cefpodoxime prédisposent le patient au risque d’encéphalopathie (qui peut inclure des convulsions, une confusion, des troubles de la conscience ou des mouvements anormaux) et, particulièrement, en cas de surdosage ou d’insuffisance rénale.
Précautions d’emploi
· Chez les patients allergiques à d’autres bêta-lactamines, il faut tenir compte de la possibilité d’allergie croisée ;
· En cas d’insuffisance rénale sévère, il peut être nécessaire d’adapter la dose quotidienne en fonction de la clairance de la créatinine (voir rubrique 4.2) ;
· Ce médicament ne doit pas être utilisé chez l’enfant de moins de 15 jours, en l’absence d’études précises ;
· Comme avec d’autres antibiotiques à large spectre, l’utilisation prolongée de cefpodoxime proxétil peut entraîner une sélection des germes non sensibles, ce qui peut nécessiter l’interruption du traitement ;
· Interactions avec les examens de laboratoire :
Une positivation du test de Coombs a été décrite au cours du traitement par les céphalosporines.
Il peut se produire une réaction faussement positive lors de la recherche de glucose dans les urines avec des substances réductrices, mais non lorsqu’on utilise des méthodes à la glucose oxydase.
Excipients à effet notoire
Ce médicament contient du saccharose. Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament. Le médicament peut être nocif pour les dents s’il doit être pris de manière prolongée, par exemple pendant deux semaines ou plus.
Ce médicament contient 25 mg d’aspartam pour 5 ml de suspension reconstituée. L’aspartam contient une source de phénylalanine. Cela peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement. Il n’existe aucune donnée clinique ou non clinique concernant l’utilisation de l’aspartam chez les enfants âgés de moins de 12 semaines.
Ce médicament contient 35,60 mg de sodium par flacon de 50 ml de suspension reconstituée (équivalent à 50 doses-kg) et 71,2 mg de sodium par flacon de 100 ml de suspension reconstituée (équivalent à 100 doses-kg). A titre indicatif, cela équivaut respectivement à 1,8 % et 3,6 % de l’apport alimentaire quotidien maximal recommandé par l’OMS de 2 g de sodium pour un adulte.
Ce médicament contient du benzoate de sodium. Le sel de benzoate peut accroitre le risque ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Augmentation du pH gastrique : les anti-H2 (ranitidine) et anti-acides (hydroxyde d’aluminium, bicarbonate de sodium) conduisent à une diminution de la biodisponibilité.
En revanche, une diminution du pH gastrique (pentagastrine) provoque une augmentation de la biodisponibilité.
Les conséquences cliniques restent à établir.
Problèmes particuliers du déséquilibre de l’INR
De nombreux cas d’augmentation de l’activité des anticoagulants oraux ont été rapportés chez des patients recevant des antibiotiques. Le contexte infectieux ou inflammatoire marqué, l’âge et l’état général du patient apparaissent comme des facteurs de risque.
Dans ces circonstances, il apparaît difficile de faire la part entre la pathologie infectieuse et son traitement dans la survenue du déséquilibre de l’INR. Cependant, certaines classes d’antibiotiques sont davantage impliquées : il s’agit notamment des fluoroquinolones, des macrolides, des cyclines, du cotrimoxazole et de certaines céphalosporines.
4.6. Fertilité, grossesse et allaitement 
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
Les fréquences ont été définies en utilisant les critères suivants : très fréquent (≥ 10%) ; fréquent (≥ 1% et < 10%) ; peu fréquent (≥ 0,1% et < 1%) ; rare (≥ 0,01% et < 0,1%) ; très rare (< 0,01%), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
· Affections hématologiques et du système lymphatique
Peu fréquent : neutropénie.
Rare : thrombocytose, leucopénie.
Fréquence indéterminée : agranulocytose, éosinophilie, thrombocytopénie, anémie hémolytique.
· Affections de l’oreille et du labyrinthe
Fréquent : acouphènes.
· Affections gastro-intestinales
Très fréquent : douleurs abdominales, diarrhée,
Fréquent : nausées, vomissements,
Peu fréquent : entérocolite,
Fréquence indéterminée : hématochézie, colite pseudomembraneuse, colite à clostridium difficile.
· Troubles généraux et anomalies au site d'administration
Fréquence indéterminée : malaise, asthénie.
· Affections hépatobiliaires
Fréquent : élévation des ASAT (aspartate aminotransférase), élévation des ALAT (alanine aminotransférase), élévation des phosphatases alcalines.
Fréquence indéterminée : élévation de la bilirubine sanguine, atteinte hépatique, atteinte hépatique cholestatique.
· Affections du système immunitaire
Peu fréquent : réactions anaphylactiques, bronchospasme.
Fréquence indéterminée : choc anaphylactique, oedème de Quincke.
· Infections et infestations
Fréquence indéterminée : surinfection.
· Affections du système nerveux
Très fréquent : céphalées.
Fréquent : vertiges.
Fréquence indéterminée : paresthésie.
Les bêta-lactamines incluant le cefpodoxime prédisposent le patient au risque d’encéphalopathie (qui peut inclure des convulsions, une confusion, des troubles de la conscience ou des mouvements anormaux) et, particulièrement, en cas de surdosage ou d’atteinte de la fonction rénale.
· Affections de la peau et du tissu sous-cutané
Fréquent : rash, prurit, urticaire.
Fréquence indéterminée : purpura, dermatite bulleuse, érythème polymorphe, syndrome de Stevens-Johnson, nécrolyse épidermique toxique (syndrome de Lyell).
· Affections du rein et des voies urinaires
Rare : faible augmentation de l’urée sanguin et de la créatininémie
Fréquence indéterminée : des atteintes de la fonction rénale ont été rapportées avec des antibiotiques appartenant à la même classe thérapeutique que cefpodoxime, notamment lorsqu’ils sont associés à des aminoglycosides et/ou des diurétiques puissants.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Classe pharmacothérapeutique : antibactériens à usage systémique, code ATC : J01DD13.
Le cefpodoxime proxétil est un antibiotique semi-synthétique de la famille des bêta-lactamines, du groupe des céphalosporines orales de troisième génération, prodrogue du cefpodoxime.
Après administration par voie orale, le cefpodoxime proxétil est absorbé en milieu intestinal et rapidement hydrolysé par des estérases non spécifiques en cefpodoxime, antibiotique bactéricide.
Le mécanisme d’action du cefpodoxime repose sur l’inhibition de la synthèse des parois bactériennes. Le cefpodoxime est stable vis à vis de nombreuses bêta-lactamases.
SPECTRE D’ACTIVITE ANTIBACTERIENNE
Les concentrations critiques séparent les souches sensibles des souches de sensibilité intermédiaire et ces dernières, des résistantes :
S ≤1 mg/l et R >2 mg/l
La prévalence de la résistance acquise peut varier en fonction de la géographie et du temps pour certaines espèces. Il est donc utile de disposer d’informations sur la prévalence de la résistance locale, surtout pour le traitement d’infections sévères. Ces données ne peuvent apporter qu’une orientation sur les probabilités de la sensibilité d’une souche bactérienne à cet antibiotique.
Lorsque la variabilité de la prévalence de la résistance en France est connue pour une espèce bactérienne, elle est indiquée dans le tableau ci- dessous :
|
Catégories |
Fréquence de résistance acquise en France (> 10%) (valeurs extrêmes) |
|
ESPÈCES SENSIBLES |
|
|
|
|
|
Aérobies à Gram positif |
|
|
Corynebacterium diphtheriae |
|
|
Streptococcus |
|
|
Streptococcus pneumoniae |
20 - 60 % |
|
|
|
|
Aérobies à Gram négatif |
|
|
Branhamella catarrhalis |
|
|
Citrobacter koseri |
|
|
Escherichia coli |
|
|
Haemophilus influenzae |
|
|
Klebsiella |
0 - 30 % |
|
Neisseria gonorrhoeae |
|
|
Pasteurella |
|
|
Proteus mirabilis |
|
|
Proteus vulgaris |
29 - 38 % |
|
Providencia |
|
|
|
|
|
Anaérobies |
|
|
Fusobacterium |
10 - 20 % |
|
Prevotella |
30 - 70 % |
|
Propionibacterium acnes |
|
|
|
|
|
ESPÈCES MODÉRÉMENT SENSIBLES |
|
|
(in vitro de sensibilité intermédiaire) |
|
|
|
|
|
Aérobies à Gram positif |
|
|
Staphylococcus méti-S |
|
|
ESPÈCES RÉSISTANTES |
|
|
|
|
|
Aérobies à Gram positif |
|
|
Entérocoques |
|
|
Listeria monocytogenes |
|
|
Staphylococcus méti-R* |
|
|
|
|
|
Aérobies à Gram négatif |
|
|
Acinetobacter |
|
|
Citrobacter freundii |
|
|
Enterobacter |
|
|
Morganella morganii |
|
|
Pseudomonas |
|
|
Serratia |
|
|
|
|
|
Anaérobies |
|
|
Bacteroides fragilis |
|
|
Clostridium |
|
|
Peptostreptococcus |
|
*La fréquence de résistance à la méticilline est environ de 30 à 50% de l’ensemble des staphylocoques et se rencontre surtout en milieu hospitalier
5.2. Propriétés pharmacocinétiques 
Absorption
L’absorption du cefpodoxime proxétil administré par voie orale au sujet à jeun, sous forme d’un comprimé correspondant à 100 mg de cefpodoxime, est de 40 à 50%.
Celle-ci est augmentée par la prise d’aliments de sorte qu’il est recommandé que le produit soit administré au cours des repas.
Distribution
· Concentrations plasmatiques :
o Après administration par voie orale d’une dose unique de 100 mg, les concentrations plasmatiques maximales de cefpodoxime (Cmax) sont de 1 mg/l à 1,2 mg/l. Après administration d’une dose de 200 mg, les concentrations plasmatiques maximales sont de 2,2 à 2,5 mg/l. Dans les deux cas (100 ou 200 mg), elles sont atteintes (Tmax) en 2 à 3 heures.
Les concentrations résiduelles à 12 heures sont respectivement de 0.08 mg/l et de 0.18 mg/l après administration de 100 mg et de 200 mg.
o Après administration pendant 14,5 jours de 100 à 200 mg, 2 fois par jour, les paramètres pharmacocinétiques plasmatiques du cefpodoxime ne sont pas modifiés, traduisant l’absence d’accumulation du principe actif.
· Le volume de distribution du cefpodoxime est de 30-35 l chez le sujet sain jeune (= 0,43 l/kg).
· Fixation aux protéines plasmatiques
Le taux de fixation du cefpodoxime est de l’ordre de 40% et se fait principalement sur l’albumine. Cette fixation est de type non saturable.
· Diffusion humorale et tissulaire
o Le cefpodoxime a une bonne diffusion dans le parenchyme pulmonaire, la muqueuse bronchique, le liquide pleural, les amygdales et le liquide interstitiel.
o 4 à 7 heures après une prise unique de 100 mg, les concentrations amygdaliennes sont de 0,24 à 0,1 µg/g (20 à 25 % des concentrations plasmatiques).
o Après une prise unique de 200 mg de cefpodoxime, les concentrations dans le liquide interstitiel sont de 1,5 à 2,0 mg/l (80% des concentrations plasmatiques).
o 3 à 12 heures après une prise unique de 200 mg de cefpodoxime, les concentrations dans le poumon sont de 0,6 à 0,2 µg/g ; dans la plèvre, elles sont de 0,6 à 0,8 mg/l.
o Dans la muqueuse bronchique, entre 1 et 4 heures après administration de 200 mg, les concentrations de cefpodoxime sont aux alentours de 1 µg/g (40 à 45% des concentrations plasmatiques).
o Les concentrations mesurées sont supérieures aux CMI des microorganismes sensibles.
Biotransformation et élimination
· Après absorption, le métabolite principal est le cefpodoxime, résultant de l’hydrolyse du cefpodoxime proxétil ;
· Le cefpodoxime est très peu métabolisé ;
· Après absorption du cefpodoxime proxétil, 80% du cefpodoxime libéré sont éliminés sous forme inchangé dans les urines.
· La demi-vie d’élimination du cefpodoxime est en moyenne de 2,4 heures.
Sujets à risque
· Les paramètres pharmacocinétiques du cefpodoxime sont très légèrement modifiés chez le sujet âgé à fonction rénale normale.
Toutefois, la faible augmentation des concentrations sériques maximales et de la demi-vie d’élimination, ne justifie aucune réduction de posologie dans ce type de population, sauf chez les sujets dont la clairance rénale est inférieure à 40 ml/min.
· En cas d’insuffisance rénale, correspondant à une clairance de la créatinine inférieure à 40 ml/min,
l’augmentation de la demi-vie d’élimination plasmatique et des concentrations plasmatiques maximales conduit à réduire la dose de moitié en l’administrant en une seule prise quotidienne.
· En cas d’insuffisance hépatique, les faibles modifications cinétiques observées ne justifient pas une adaptation spécifique de la posologie.
CHEZ L’ENFANT :
Après administration par voie orale d’une dose unique de 5 mg/kg (200 mg maximum) exprimé en cefpodoxime, à des sujets âgés de 4 à 12 ans, les concentrations plasmatiques maximales de cefpodoxime (Cmax) sont en moyenne de 2,6 mg/l. Elles sont atteintes en 2 à 4 heures.
Chez les patients de moins de 2 ans lors d’une administration répétée de 5 mg/kg toutes les 12 heures, les concentrations plasmatiques moyennes, 2 heures après administration, sont comprises entre 2,7 mg/l (1 mois- 6 mois) et 2,0 mg/l (7 mois-2 ans).
Chez les patients âgés de 1 mois à 12 ans après administration répétée de 5 mg/kg toutes les 12 heures, les concentrations plasmatiques résiduelles de cefpodoxime (C12h) à l’état d’équilibre sont comprises entre 0,2 à 0,3 mg/l (1 mois-2 ans) et 0,1 mg/l (2 ans – 12 ans).
5.3. Données de sécurité préclinique 
3 ans.
Après reconstitution: 14 jours.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C.
Après reconstitution : à conserver au réfrigérateur (entre 2°C et 8°C).
6.5. Nature et contenu de l'emballage extérieur 
Flacon de 50 ml ou 100 ml (verre brun) avec fermeture de sécurité enfant et seringue (PE/PP) pour administration orale graduée en kg.
Toutes les présentations peuvent ne pas être commercialisées.
6.6. Précautions particulières d’élimination et de manipulation 
Pas d'exigences particulières.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
26 avenue Tony Garnier
69007 LYON
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 387 501-2 ou 34009 387 501 2 6: Flacon de 100 ml (verre brun) avec fermeture de sécurité enfant et seringue (PE/PP) pour administration orale graduée en kg. Boîte de 1.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I.
ANSM - Mis à jour le : 17/09/2021
CEFPODOXIME ARROW ENFANTS ET NOURRISSONS 40 mg /5 ml, poudre pour suspension buvable
Cefpodoxime proxétil
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ?
3. Comment utiliser CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable ET DANS QUELS CAS EST-IL UTILISE ? 
Classe pharmacothérapeutique : antibactériens à usage systémique - code ATC : J01DD13
Ce médicament est un antibiotique antibactérien de la famille des bêta-lactamines.
Ce médicament est indiqué chez l’enfant dans le traitement de certaines infections bactériennes à germes sensibles.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ? 
· si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6 ;
· en cas d’allergie connue aux antibiotiques du groupe des céphalosporines ;
· en cas de phénylcétonurie (maladie héréditaire dépistée à la naissance), en raison de la présence d’aspartam.
Avertissements et précautions
· Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser CEFPODOXIME ARROW ENFANTS ET NOURRISSONS 40 mg/5 ml, poudre pour suspension buvable.
· Toute manifestation allergique (éruption cutanée, démangeaisons...) en cours de traitement doit être signalée immédiatement à votre médecin.
· Il existe une possibilité d’allergie (5 à 10% des cas) chez les sujets allergiques aux pénicillines.
Signaler à votre médecin toute allergie ou manifestations allergiques survenues lors de traitement par les antibiotiques du groupe des pénicillines.
· La survenue de diarrhée au cours d’un traitement antibiotique ne doit pas être traitée sans avis médical.
· En raison de la nécessité d’adapter le traitement, il est important de prévenir le médecin de toute maladie rénale.
· Chez le nourrisson de moins de 15 jours, il est recommandé de ne pas utiliser ce produit.
· Ce médicament peut provoquer une fausse réaction positive de certains examens de laboratoire (recherche de glucose dans les urines, test de Coombs).
· Comme pour l'ensemble des médicaments appartenant à cette classe d’antibiotiques (les bêta lactamines), l'administration de ce médicament peut entraîner un risque d'encéphalopathie pouvant se traduire par des convulsions, une confusion, des troubles de la conscience, ou encore des mouvements anormaux, particulièrement en cas de surdosage ou en cas d’altération du fonctionnement du rein. Si de tels troubles apparaissent, consultez immédiatement votre médecin ou votre pharmacien (voir rubriques 3 et 4).
Autres médicaments et CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable
Prise ou utilisation d'autres médicaments :
Informez votre médecin ou pharmacien si vous utilisez, avez récemment utilisé ou pourriez utiliser tout autre médicament.
Prévenez en particulier votre médecin si vous prenez :
· des médicaments qui augmentent le pH gastrique (ranitidine, hydroxyde d’aluminium, bicarbonate de sodium) car cela conduit à une diminution de l’absorption de CEFPODOXIME ARROW ENFANT ET NOURISSONS ;
· des médicaments qui diminuent le pH gastrique (pentagastrine) car cela conduit à une augmentation de l’absorption de CEFPODOXIME ARROW ENFANT ET NOURISSONS ;
· des médicaments utilisés pour fluidifier le sang (anticoagulant) : leur activité peut être augmentée avec certains antibiotiques.
Conduite de véhicules et utilisation de machines
Ce médicament peut avoir une influence importante sur l'aptitude à conduire des véhicules ou à utiliser des machines notamment du fait de la survenue possible de vertiges ou d'une encéphalopathie (pouvant se traduire par des convulsions, une confusion, des troubles de conscience, ou des mouvements anormaux) (voir rubriques 3 et 4).
CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable contient du saccharose, de l’aspartam, du sodium et du benzoate de sodium.
· Ce médicament contient du saccharose. Si votre médecin vous a informé(e) que vous avez une intolérance à certains sucres, contactez votre médecin avant de prendre ce médicament. Le médicament peut être nocif pour les dents s’il doit être pris de manière prolongée, par exemple pendant deux semaines ou plus.
· Ce médicament contient 25 mg d’aspartam pour 5 ml de suspension reconstituée. L’aspartam contient une source de phénylalanine. Cela peut être dangereux pour les personnes atteintes de phénylcétonurie (PCU), une maladie génétique rare caractérisée par l’accumulation de phénylalanine ne pouvant être éliminée correctement.
· Ce médicament contient 35,60 mg de sodium par flacon de 50 ml de suspension reconstituée (équivalent à 50 doses-kg) et 71,2 mg de sodium par flacon de 100 ml de suspension reconstituée (équivalent à 100 doses-kg). A titre indicatif, cela équivaut respectivement à 1,8 % et 3,6 % de l’apport alimentaire quotidien maximal recommandé de sodium pour un adulte.
· Ce médicament contient du benzoate de sodium. Le sel de benzoate peut accroitre le risque ictère (jaunissement de la peau et des yeux) chez les nouveau-nés (jusqu’à 4 semaines).
3. COMMENT UTILISER CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ? 
Posologie
La posologie chez l’enfant varie selon l’âge et le poids.
A titre indicatif, la posologie usuelle chez l’enfant est de 8 mg par kg et par jour, sans dépasser la dose adulte (c’est-à-dire 200 mg/jour en cas d’angine et 400 mg/jour dans les autres indications), à prendre en 2 prises, à 12 heures d’intervalle.
|
La dose par prise est indiquée sur la seringue graduée par les graduations correspondant au poids de l’enfant en kg (graduations de 5 à 25 kg). La dose par prise se lit donc directement. Ainsi, le point indiqué correspond à la dose pour une prise. La dose à administrer pour une prise est donc obtenue en tirant le piston jusqu’à la graduation correspondant au poids de l’enfant (la dose se lit au niveau de la collerette du corps de la seringue). Deux prises par jour sont nécessaires. Par exemple, la graduation n°12 correspond à la dose à administrer par prise pour un enfant de 12 kg, et ce, deux fois par jour. |
Si votre enfant a une maladie des reins, votre médecin adaptera la dose à votre situation.
Mode d’administration
Voie orale.
A lire attentivement avant ouverture du flacon.
Flacon (verre brun) avec bouchon contenant une capsule déshydratante :
· Dévisser le bouchon du flacon en appuyant (voir schéma 1).
· Retirer la capsule déshydratante qui protège la poudre de l’humidité, située à l’intérieur du bouchon, en tirant sur les deux petites ailettes puis la jeter (voir schéma 2).
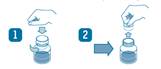
· Ajouter de l’eau jusqu’à mi-hauteur par rapport au trait de jauge. Agiter vigoureusement.
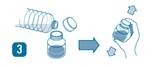
· Compléter avec de l’eau jusqu’au trait et agiter de nouveau vigoureusement jusqu’à complète homogénéisation.

· Refermer soigneusement après usage. Agiter la suspension avant chaque utilisation.
· Une fois mélangée à l’eau, servez-vous de la seringue pour administration orale contenue dans la boîte pour prélever la quantité nécessaire de solution dans le flacon.
Comment utiliser la seringue pour administration orale ?
Il est important d’utiliser la seringue pour administration orale contenue dans la boîte, pour donner à votre enfant la bonne dose. N’utilisez pas la seringue pour administration orale pour un autre médicament, la graduation de la seringue pour administration orale étant spécifique à ce produit.
La dose par prise est indiquée sur le piston de la seringue pour administration orale graduée en kg (graduation de 5 à 25 kg).
La dose par prise correspond au poids de l’enfant.
La dose à administrer pour une prise est obtenue en tirant le piston jusqu’à la graduation correspondant au poids de l’enfant. La dose se lit au niveau de la collerette de la seringue.
Par exemple, la graduation 12 kg correspond à la dose à administrer par prise pour un enfant de 12 kg, et ce, 2 fois par jour (2 prises par jour étant nécessaires).
Après chaque utilisation, vous devez refermer soigneusement le flacon et bien rincer puis sécher la seringue pour administration orale.
Fréquence d’administration
Deux prises par jour, au cours des repas.
Durée du traitement
Pour être efficace, cet antibiotique doit être utilisé régulièrement aux doses prescrites, et aussi longtemps que votre médecin vous l’aura conseillé.
La disparition de la fièvre, ou de tout autre symptôme, ne signifie pas que vous êtes complètement guéri.
L’éventuelle impression de fatigue n’est pas due au traitement antibiotique, mais à l’infection elle-même. Le fait de réduire ou de suspendre votre traitement serait sans effet sur cette impression et retarderait votre guérison.
Cas particulier : la durée du traitement de certaines angines est de 5 jours.
Si vous avez utilisé plus de CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable que vous n’auriez dû
Comme pour l'ensemble des médicaments appartenant à cette classe d’antibiotiques (les bêta-lactamines), l'administration de ce médicament, en particulier en cas de surdosage, peut entraîner un risque d'encéphalopathie pouvant se traduire par des convulsions, une confusion, des troubles de la conscience, ou encore des mouvements anormaux. Si de tels troubles apparaissent, consultez immédiatement votre médecin ou votre pharmacien (voir rubrique 2 et 4).
Si vous oubliez d’utiliser CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable
Si vous arrêtez d’utiliser CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? 
Très fréquents (peut toucher plus d’1 patient sur 10) :
· manifestations digestives : douleurs au ventre, diarrhée,
· maux de tête.
Fréquents (peut toucher jusqu’à 1 patient sur 10) :
· bourdonnements dans les oreilles (acouphènes),
· manifestations digestives : nausées, vomissements,
· augmentation des enzymes du foie (transaminases et phosphatases alcalines),
· sensations de vertiges,
· manifestations cutanées : éruptions cutanées, démangeaisons, urticaire.
Peu fréquents (peut toucher jusqu’à 1 patient sur 100) :
· diminution du taux de certains globules blancs (neutropénie),
· inflammation de l’intestin (entérocolite),
· réactions allergiques pouvant être sévères (réactions anaphylactiques), difficultés soudaines à respirer (bronchospasme).
Rares (peut toucher 1 à 10 patients sur 10 000) :
· faible augmentation de l’urée et de la créatinine dans le sang.
Fréquence indéterminée (ne peut pas être évaluée à partir des données disponibles) :
· manifestations hématologiques : baisse du taux de plaquettes, diminution du taux de globules rouges (anémie), chute importante du taux de certains globules blancs (agranulocytose), augmentation du taux de certains globules blancs (éosinophilie) ;
· saignement anal, maladie du gros intestin caractérisée par l’expulsion de fausses membranes ou de glaires, diarrhée et douleurs au ventre (colite pseudomembraneuse), diarrhée due à une bactérie clostridium difficile ;
· malaise, fatigue ;
· augmentation de certains éléments du sang (bilirubine), atteinte du foie ;
· manifestations allergiques : manifestation allergique pouvant conduire à un arrêt circulatoire (choc allergique), brusque gonflement du visage et du cou d’origine allergique (œdème de Quincke) ;
· aggravation de l’infection (surinfection) ;
· sensation de picotements dans les mains et les pieds (paresthésies) ;
· manifestations cutanées : éruption de taches pourpres ne s'effaçant pas à la vitropression (purpura), éruption bulleuse localisée (dermatite bulleuse), maladie de la peau sous forme de rougeur (érythème polymorphe), décollement de la peau pouvant rapidement s’étendre de façon très grave à tout le corps (syndrome de Stevens-Johnson et syndrome de Lyell) ;
· atteinte de la fonction rénale (observée avec des antibiotiques appartenant à la même classe thérapeutique que cefpodoxime, notamment quand ils étaient associés à d’autres médicaments (aminoglycosides et/ou des diurétiques puissants)) ;
· troubles neurologiques graves appelés encéphalopathies à type de convulsions, de confusion, de troubles de la conscience, ou encore de mouvements anormaux en particulier en cas de surdosage ou d’altération du fonctionnement du rein (voir rubriques 2 et 3).
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER CEFPODOXIME ARROW ENFANTS ET NOURissons 40 mg/5 ml, poudre pour suspension buvable ? 
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur l’emballage après EXP.
A conserver à une température ne dépassant pas 25°C.
Après reconstitution : la suspension se conserve au maximum 14 jours au réfrigérateur (entre 2°C et 8°C).
Ne jetez aucun médicament au tout à l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS 
Ce que contient CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable 
· La substance active est :
Cefpodoxime................................................................................................................... 40 mg
Sous forme de Cefpodoxime proxétil.
Pour 5 ml de suspension reconstituée.
· Les autres composants sont : silice colloïdale hydratée, talc, trioléate de sorbitan, benzoate de sodium, chlorure de sodium, acide citrique anhydre, aspartam, galactomannane du guar, arôme citron, arôme orange, oxyde de fer jaune, saccharose.
Qu’est-ce que CEFPODOXIME ARROW ENFANTS ET NOURISSONS 40 mg/5 ml, poudre pour suspension buvable et contenu de l’emballage extérieur 
Poudre pour suspension buvable.
Flacon de 50 ml ou 100 ml avec fermeture de sécurité enfant et seringue pour administration orale graduée.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
26 avenue Tony Garnier
69007 LYON
Exploitant de l’autorisation de mise sur le marché 
26 avenue Tony Garnier
69007 LYON
biochemiestrasse 10
6250 kundl
AUTRICHE
OU
famar sa
48th kilometer national road n°1
19011 AVLONAS, ATHENES
GRECE
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Sans objet.
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
CONSEILS / EDUCATION SANITAIRE
QUE SAVOIR SUR LES ANTIBIOTIQUES ?
Les antibiotiques sont efficaces pour combattre les infections dues aux bactéries. Ils ne sont pas efficaces contre les infections dues aux virus.
Aussi, votre médecin a choisi de vous prescrire cet antibiotique parce qu’il convient précisément à votre cas et à votre maladie actuelle.
Les bactéries ont la capacité de survivre ou de se reproduire malgré l’action d’un antibiotique. Ce phénomène est appelé résistance : il rend certains traitements antibiotiques inactifs.
La résistance s’accroît par l’usage abusif ou inapproprié des antibiotiques.
Vous risquez de favoriser l’apparition de bactéries résistantes et donc de retarder votre guérison ou même de rendre inactif ce médicament, si vous ne respectez pas :
· la dose à prendre,
· les moments de prise,
· et la durée de traitement.
En conséquence, pour préserver l’efficacité de ce médicament :
1- N’utilisez un antibiotique que lorsque votre médecin vous l’a prescrit.
2- Respectez strictement votre ordonnance.
3- Ne réutilisez pas un antibiotique sans prescription médicale même si vous pensez combattre une maladie apparemment semblable.
4- Ne donnez jamais votre antibiotique à une autre personne, il n’est peut-être pas adapté à sa maladie.
5- Une fois votre traitement terminé, rapportez à votre pharmacien toutes les boîtes entamées pour une destruction correcte et appropriée de ce médicament.




