NICARDIPINE ARROW
Dosage: 10mg/10ml

Cliquez sur un pictogramme pour aller directement à la rubrique le concernant.
Pour plus d'information sur les pictogrammes, consultez l'aide.
Indications thérapeutiques
NICARDIPINE ARROW est utilisée pour traiter l’hypertension artérielle très sévère. Elle peut également être utilisée pour contrôler l’hypertension artérielle après une opération.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
Groupe(s) générique(s)
Ce médicament appartient au(x) groupe(s) générique(s) suivants :
Composition en substances actives
-
 Solution (Composition pour une ampoule de 10 ml)
Solution (Composition pour une ampoule de 10 ml)
-
> chlorhydrate de nicardipine
 10 mg
10 mg
-
> chlorhydrate de nicardipine
Présentations
> 10 ampoule(s) en verre brun de 10 ml
Code CIP : 416 864-7 ou 34009 416 864 7 4Déclaration de commercialisation : 07/12/2011
Cette présentation est agréée aux collectivités
Tarification particulière/spécifique
Service médical rendu (SMR) 
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur du SMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| Important | Avis du 02/11/2011 | Inscription (CT) | Le service médical rendu par cette spécialité est important. |
| Important | Avis du 02/11/2011 | Inscription (CT) | Le service médical rendu par cette spécialité est important. |
Amélioration du service médical rendu (ASMR) 
Les libellés affichés ci-dessous ne sont que des résumés ou extraits issus des avis rendus par la Commission de la Transparence.
Seul l'avis complet de la Commission de la Transparence fait référence.
Cet avis est consultable à partir du lien "Avis du jj/mm/aaaa" ou encore sur demande auprès de la HAS (plus d'informations dans l'aide). Les avis et synthèses d'avis contiennent un paragraphe sur la place du médicament dans la stratégie thérapeutique.
| Valeur de l'ASMR | Avis | Motif de l'évaluation | Résumé de l'avis |
|---|---|---|---|
| V (Inexistant) | Avis du 02/11/2011 | Inscription (CT) | Cette spécialité n'apporte pas d'amélioration du service médical rendu (ASMR V). |
| V (Inexistant) | Avis du 02/11/2011 | Inscription (CT) | Cette spécialité n'apporte pas d'amélioration du service médical rendu (ASMR V). |
Autres informations (cliquer pour afficher)
- Titulaire de l'autorisation : EUGIA PHARMA (MALTA) LTD
-
Conditions de prescription et de délivrance :
- liste I
- réservé à l'usage en situation d'urgence selon l'article R5121-96 du code de la santé publique
- réservé à l'usage HOSPITALIER
- Statut de l'autorisation : Valide
- Type de procédure : Procédure nationale
- Code CIS : 6 991 320 2
ANSM - Mis à jour le : 20/10/2022
NICARDIPINE ARROW 10 mg/10 ml, solution injectable
2. COMPOSITION QUALITATIVE ET QUANTITATIVE 
Chlorhydrate de nicardipine.................................................................................................... 10 mg
Pour une ampoule de 10 ml.
1 ml de solution injectable contient 1 mg de chlorhydrate de nicardipine.
Excipient à effet notoire : une ampoule de 10 ml contient 500 mg de sorbitol (E420).
Pour la liste complète des excipients, voir rubrique 6.1.
Solution limpide.
4.1. Indications thérapeutiques 
· Hypertension artérielle maligne/Encéphalopathie hypertensive.
· Dissection aortique, quand le traitement par des bêta-bloquants à courte durée d’action n’est pas approprié, ou en association avec un bêta-bloquant quand le blocage des récepteurs bêta seul n’est pas efficace.
· Pré-éclampsie sévère, quand d’autres agents antihypertenseurs administrés par voie intraveineuse ne sont pas recommandés ou sont contre-indiqués.
La nicardipine est également indiquée dans le traitement de l’hypertension post-opératoire.
4.2. Posologie et mode d'administration 
L’effet antihypertenseur dépend de la dose administrée. La posologie pour atteindre la pression artérielle recherchée peut varier en fonction de la pression artérielle cible, la réponse du patient, et l’âge ou l’état général du patient.
A moins que l’administration ne soit faite par un cathéter veineux central, diluer le produit à une concentration de 0,1 à 0,2 mg/mL avant utilisation (voir rubrique 6.2 pour les informations concernant les solutions incompatibles)
Adultes :
Dose initiale : Le traitement doit commencer par une administration continue de nicardipine à la vitesse de 3-5 mg/h pendant 15 minutes. La vitesse peut être augmentée par palier de 0,5 ou 1 mg toutes les 15 minutes. La vitesse de perfusion ne doit pas dépasser 15 mg/h.
Dose d’entretien : Quand la pression cible est atteinte, la dose doit être réduite progressivement, jusqu’à généralement entre 2 et 4 mg/h, afin de maintenir l’efficacité thérapeutique.
Transition vers un agent antihypertenseur oral : stopper l’administration de nicardipine ou baisser la dose en même temps qu’un traitement oral approprié est instauré. Au cours de l’initiation du traitement antihypertenseur oral, prendre en compte le temps de latence avant l’apparition de l’effet du traitement oral. Poursuivre la surveillance de la pression artérielle jusqu’à l’obtention de l’effet recherché.
Le relais peut également être pris par un traitement par administration par voie orale de comprimés de nicardipine 20 mg, à la posologie de 60 mg/jour en 3 doses quotidiennes, ou de gélules à libération prolongée de nicardipine 50 mg, à la posologie de 100 mg/jour en 2 prises quotidiennes.
Patients âgés :
Les études cliniques sur la nicardipine n’ont pas inclus suffisamment de patients âgés de 65 ans et plus pour déterminer s’ils répondent différemment par rapport aux sujets plus jeunes.
Les sujets âgés peuvent être plus sensibles aux effets de la nicardipine en raison d’une altération de la fonction rénale et/ou hépatique. Il est recommandé d’utiliser une perfusion continue de nicardipine en commençant à la dose de 1 à 5 mg/h, en fonction de la pression artérielle et de l’état clinique. Après 30 minutes, en fonction de l’effet observé, la vitesse peut être augmentée ou diminuée par paliers de 0,5 mg/h. La vitesse ne doit pas dépasser 15 mg/h.
Grossesse :
Il est recommandé d’utiliser une perfusion continue de nicardipine débutant à la dose de 1 à 5 mg/h en fonction de la pression artérielle et de l’état clinique. Après 30 minutes, en fonction de l’effet observé, la vitesse peut être diminuée ou augmentée par palier de 0,5 mg/h.
Dans le traitement de la pré-éclampsie, les doses supérieures à 4 mg/h ne sont généralement pas dépassées. La vitesse maximale ne doit pas dépasser 15 mg/h. (Voir rubriques 4.4, 4.6 et 4.8)
Insuffisance hépatique :
La nicardipine doit être utilisée avec précaution chez ces patients. La nicardipine étant métabolisée par le foie, il est recommandé d’utiliser le schéma posologique préconisé pour les patients âgés chez les patients présentant une insuffisance hépatique ou une diminution du flux sanguin hépatique.
Insuffisance rénale :
La nicardipine doit être utilisée avec précaution chez ces patients. Chez des patients présentant une insuffisance rénale modérée, il a été observé une clairance systémique significativement plus basse et une aire sous la courbe plus élevée (AUC). Il est donc recommandé d’utiliser le schéma posologique préconisé pour les patients âgés chez les patients atteints d’insuffisance rénale.
Population pédiatrique :
La sécurité et l’efficacité de la nicardipine chez les nouveau-nés de faible poids de naissance, les nouveau-nés, les nourrissons allaités, les nourrissons et les enfants n’ont pas été établies.
La nicardipine doit être utilisée uniquement en cas d’hypertension menaçant le pronostic vital en soins intensifs pédiatriques ou dans des contextes post-opératoires.
Dose initiale : En cas d’urgence, une dose initiale de 0,5 à 5 mcg/kg/min est recommandée.
Dose d’entretien : La dose d’entretien recommandée est de 1 à 4 mcg/kg/min.
La nicardipine doit être utilisée avec précautions chez les enfants atteints d’insuffisance rénale. Dans ce cas, la plus faible posologie efficace doit être administrée.
Mode d’administration
La nicardipine doit être administrée uniquement en perfusion intraveineuse continue.
La nicardipine doit être administrée uniquement par des spécialistes dans un environnement médical bien contrôlé, tel que les hôpitaux et unités de soins intensifs, avec une surveillance continue de la pression artérielle. La vitesse d’administration doit être précisément contrôlée à l’aide d’un pousse-seringue électronique ou d’une pompe volumétrique. La pression artérielle et la fréquence cardiaque doivent être surveillées au minimum toutes les 5 minutes pendant la perfusion, puis jusqu’à stabilisation des signes vitaux et au moins pendant 12 heures après la fin de l’administration de nicardipine.
· Hypersensibilité à la substance active ou à l’un des excipients mentionnés à la rubrique 6.1.
· Sténose aortique sévère.
· Hypertension compensatoire, en cas de shunt artérioveineux ou de coarctation de l’aorte.
· Angor instable.
· Dans les 8 jours après un infarctus du myocarde.
4.4. Mises en garde spéciales et précautions d'emploi 
Une administration par bolus ou une administration intraveineuse non contrôlée par l’utilisation d’un pousse-seringue électronique ou d’une pompe volumétrique n’est pas recommandée et peut augmenter le risque d’hypotension sévère, en particulier chez les sujets âgés, les enfants, les patients atteints d’insuffisance rénale ou hépatique et pendant la grossesse.
Insuffisance cardiaque
La nicardipine doit être utilisée avec précautions chez les patients atteints d’insuffisance cardiaque congestive ou d’œdème pulmonaire, en particulier chez les patients avec traitement bêtabloquant concomitant, en raison du risque d’aggravation de l’insuffisance cardiaque.
Maladie cardiovasculaire ischémique
La nicardipine est contre-indiquée dans l’angor instable et dans les suites immédiates d’un infarctus du myocarde (voir rubrique 4.3).
La nicardipine doit être utilisée avec précautions chez les patients pour lesquels une ischémie coronarienne est suspectée. Occasionnellement, des patients ont développé une augmentation de la fréquence, de la durée ou de la sévérité de l’angor à l’initiation ou lors d’augmentation des doses de nicardipine, ou au cours du traitement.
Grossesse
En raison du risque d’hypotension maternelle sévère et d’hypoxie fœtale potentiellement fatale, la diminution de la pression artérielle doit être progressive et toujours étroitement surveillée. En raison du risque potentiel d’œdème pulmonaire ou d’une diminution excessive de la pression artérielle, des précautions doivent être prises en cas d’administration concomitante de sulfate de magnésium.
Des cas d’œdèmes pulmonaires aigus ayant été rapportés durant la grossesse, la nicardipine doit être administrée avec précaution chez les femmes enceintes, et celles-ci doivent faire l’objet d’une surveillance étroite afin de déceler l’apparition éventuelle d’un œdème pulmonaire aigu. En cas de survenue d’un œdème pulmonaire aigu, il convient d’arrêter immédiatement le traitement par la nicardipine et d’instaurer un traitement approprié.
Patients avec des antécédents de dysfonctionnement hépatique ou d’insuffisance hépatique
Il a été rapporté de rares cas d’anomalies de la fonction hépatique possiblement associées à l’administration de nicardipine. Les groupes potentiellement à risque correspondent aux patients ayant des antécédents de dysfonction hépatique ou ceux présentant une insuffisance hépatique à l’initiation du traitement par la nicardipine. La nicardipine doit être utilisée avec prudence chez les patients présentant une insuffisance hépatique.
Insuffisance rénale
La nicardipine doit être utilisée avec prudence chez les patients présentant une insuffisance rénale (voir rubrique 5.2).
Patients atteints d’hypertension portale
Il a été rapporté que des doses élevées de nicardipine administrée par voie intraveineuse peuvent aggraver l’hypertension portale et l’index de circulation collatérale porto-systémique chez les patients cirrhotiques.
Patients avec hypertension intracrânienne préexistante
La nicardipine doit être utilisée avec précaution chez les patients ayant un risque d’augmentation de la pression intracrânienne. La pression intracrânienne doit être surveillée pour permettre le calcul de la pression de perfusion cérébrale.
Patients présentant un accident vasculaire cérébral
La nicardipine doit être utilisée avec précaution chez les patients présentant un infarctus cérébral aigu. L’épisode d’hypertension qui accompagne souvent un accident vasculaire cérébral n’est pas une indication pour un traitement antihypertenseur d’urgence.
L’utilisation de médicaments antihypertenseurs n’est pas recommandée en cas d’accident vasculaire cérébral ischémique, sauf si l’accès hypertensif empêche l’administration d’un traitement adéquat (par ex. thrombolytique) ou en cas d’autres atteintes organiques potentiellement fatales à court terme.
Association avec des bêta-bloquants
Des précautions sont nécessaires lors de l’administration de la nicardipine en association avec un bêta-bloquant chez des patients présentant une diminution de la fonction cardiaque. Dans de tels cas, la posologie du bêta-bloquant doit être ajustée en fonction de la situation clinique individuelle. (Voir rubrique 4.5)
Réactions au site d’injection
Des réactions au site de perfusion peuvent survenir, en particulier lors d’administrations prolongées et dans les veines périphériques. Il est conseillé de changer de site de perfusion en cas de suspicion d’une irritation au niveau du site d’injection. L’utilisation d’une voie veineuse centrale ou d’une solution plus diluée peut réduire le risque de survenue de réaction au niveau du site d’injection.
Population pédiatrique
La sécurité et l’efficacité de la nicardipine en IV n’ont pas été testées au cours d’essais cliniques contrôlés chez les nourrissons ou les enfants, il est donc nécessaire de prendre des précautions particulières dans cette population (voir rubrique 4.2).
Excipient
Ce médicament contient du sorbitol. Son utilisation est déconseillée chez les patients présentant une intolérance au fructose (maladie héréditaire rare).
4.5. Interactions avec d'autres médicaments et autres formes d'interactions 
Dantrolène
Avec le dantrolène administré par perfusion :
Dans des études chez l’animal, des cas de fibrillations ventriculaires mortelles sont constamment observées lors de l’administration de vérapamil et de dantrolène par voie intraveineuse. L’association d’un antagoniste du calcium et de dantrolène est donc potentiellement dangereuse. Cependant, quelques patients ont reçu l’association nifédipine et dantrolène sans inconvénient.
Associations faisant l'objet de précautions d’emploi
Idélalisib
Majoration des effets indésirables de la nicardipine, à type d’hypotension orthostatique, notamment chez le sujet âgé.
Surveillance clinique et adaptation de la posologie de la nicardipine pendant le traitement par l’idélalisib et après son arrêt.
Immunosuppresseurs (ciclosporine, everolimus, sirolimus, tacrolimus, temsirolimus)
Augmentation des concentrations sanguines de l’immunosuppresseur, par inhibition de son métabolisme. Dosage des concentrations sanguines de l’immunosuppresseur, contrôle de la fonction rénale et adaptation de sa posologie pendant le traitement et après l’arrêt.
Inducteurs et inhibiteurs du cytochrome CYP3A4
La nicardipine est métabolisée par le cytochrome P450 3A4. L’administration concomitante d’agents inducteurs du CYP 3A4 (tels que carbamazépine, phénobarbital, phénytoïne, fosphénytoïne, primidone et rifampicine) peut entraîner une diminution des concentrations plasmatiques de nicardipine par augmentation de son métabolisme hépatique.
Surveillance clinique et adaptation éventuelle de la posologie de la nicardipine pendant le traitement par l’anticonvulsivant et après son arrêt.
L’administration simultanée d’agents inhibiteurs puissants de l’enzyme CYP3A4 (tels que cimétidine, clarithromycine, cobicistat, érythromycine, itraconazole, jus de pamplemousse, kétoconazole, nelfinavir, posaconazole, ritonavir, télaprévir, télithromycine, voriconazole) peut augmenter la concentration plasmatique de nicardipine. Majoration des effets indésirables de la nicardipine, le plus souvent à type d'hypotension notamment chez le sujet âgé.
L’administration simultanée d’inhibiteurs des canaux calciques et d’itraconazole a montré un risque accru d’effets indésirables, particulièrement d’œdèmes dus à une baisse du métabolisme hépatique de l’inhibiteur des canaux calciques.
Surveillance clinique et adaptation posologique de la nicardipine pendant le traitement par l’inhibiteur enzymatique puissant du CYP3A4 et après son arrêt.
Associations à prendre en compte
Effet antihypertenseur additif potentiel
Les médicaments susceptibles de potentialiser l’effet antihypertenseur de la nicardipine lors de l’administration concomitante, avec un risque d’hypotension orthostatique majoré, incluent le baclofène, les alpha-bloquants à visée urologique (alfuzosine, doxazosine, prazosine, silodosine, tamsulosine, térazosine), les antihypertenseurs alpha-bloquants (doxazosine, prazosine, urapidil),, les antidépresseurs tricycliques, les antidépresseurs imipraminiques,les neuroleptiques, les opioïdes et l’amifostine.
Dérivé nitrés et apparentés
Majoration du risque d’hypotension, notamment orthostatique.
Médicaments à l’origine d’une hypotension orthostatique
Risque de majoration d’une hypotension, notamment orthostatique.
Anesthésiques par inhalation
L’administration simultanée de nicardipine et d’anesthésiques par inhalation pourrait induire un effet hypotenseur additif ou synergique, ainsi qu’une inhibition par les anesthésiques de l’augmentation baroréflexe de la fréquence cardiaque associée aux vasodilatateurs périphériques. Des données cliniques limitées suggèrent que l’effet des anesthésiques inhalés (par ex. isoflurane, sévoflurane et enflurane) sur la nicardipine paraît modéré.
Augmentation de l’effet inotrope négatif
La nicardipine peut augmenter l’effet inotrope négatif des bêta-bloquants dans l’insuffisance cardiaque (bisoprolol, carvédilol, métoprolol, nébivolol) et entraîner une hypotension, une défaillance cardiaque chez les patients présentant une insuffisance cardiaque latente ou non contrôlée (voir rubrique 4.4). La présence d’un traitement bêta-bloquant peut par ailleurs minimiser la réaction sympathique réflexe mise en jeu en cas de répercussion hémodynamique excessive.
La nicardipine peut augmenter l’effet inotrope négatif des bêta-bloquants (sauf esmolol) et entraîner une hypotension, une défaillance cardiaque chez les patients présentant une insuffisance cardiaque latente ou non contrôlée (voir rubrique 4.4) (addition des effets inotropes négatifs). Le bêta-bloquant peut par ailleurs minimiser la réaction sympathique réflexe mise en jeu en cas de répercussion hémodynamique excessive.
Magnésium
En raison du risque potentiel d’œdème pulmonaire ou d’une diminution excessive de la pression artérielle, des précautions doivent être prises en cas d’utilisation concomitante de sulfate de magnésium (voir rubrique 4.4)
Digoxine
Des études pharmacocinétiques ont montré que la nicardipine augmente les taux plasmatiques de digoxine. Les taux de digoxine doivent être surveillés lors de l’initiation d’un traitement concomitant par nicardipine.
Diminution de l’effet antihypertenseur
La nicardipine en association avec les corticostéroïdes intraveineux (glucocorticoïdes et minéralocorticoïdes) et le tétracosactide (excepté l’hydrocortisone utilisée comme traitement de substitution dans la maladie d’Addison) peut entraîner une réduction de l’effet antihypertenseur
Inhibiteurs neuromusculaires compétitifs
Des données limitées suggèrent que la nicardipine, comme d’autres inhibiteurs des canaux calciques, augmente le bloc neuromusculaire probablement en agissant sur la région post-synaptique. L’utilisation concomitante de nicardipine pourrait réduire la dose de vécuronium à perfuser. L’antagonisation du bloc neuromusculaire par la néostigmine ne semble pas affectée par la perfusion de nicardipine. Aucune surveillance supplémentaire n’est nécessaire.
4.6. Fertilité, grossesse et allaitement 
Grossesse
Les études chez l’animal n’ont pas mis en évidence d’effet tératogène. En l’absence d’effet tératogène chez l’animal, un effet malformatif dans l’espèce humaine n’est pas attendu. En effet, à ce jour, les substances responsables de malformations dans l’espèce humaine se sont révélées tératogènes chez l’animal au cours d’études bien conduites sur deux espèces. La nicardipine ne devrait être utilisée que si le bénéfice est supérieur au risque car une réduction du poids de naissances chez les nouveau-nés a été rapportée en association avec des inhibiteurs des canaux calciques.
Des données pharmacocinétiques limitées ont montré que la nicardipine IV ne s’accumule pas ; le passage de la barrière placentaire est faible.
En pratique clinique, l’utilisation de nicardipine pendant les deux premiers trimestres dans un nombre limité de grossesses n’a révélé aucun effet tératogène ni fœtotoxique particulier.
L’utilisation de nicardipine pour traiter une pré-éclampsie sévère pendant le troisième trimestre de grossesse pourrait potentiellement produire un effet tocolytique qui pourrait potentiellement interférer avec l’induction spontanée du travail.
Des œdèmes pulmonaires aigus ont été observés lors de l’utilisation de nicardipine comme tocolytique pendant la grossesse (voir rubriques 4.4 et 4.8), particulièrement en cas de grossesse multiple (jumeaux ou plus), par voie intraveineuse et/ou avec utilisation concomitante de bêta-2-agonistes. La nicardipine ne doit pas être utilisée en cas de grossesse multiple ni chez des femmes enceintes dont l’état cardiovasculaire est compromis, à moins qu’il n’y ait aucune autre alternative acceptable.
La nicardipine ne doit pas être utilisée pendant l’allaitement (voir rubrique 5.3).
Fertilité
Sans objet.
4.7. Effets sur l'aptitude à conduire des véhicules et à utiliser des machines 
La majorité des effets indésirables de la nicardipine sont la conséquence de ses effets vasodilatateurs. Les effets les plus fréquents sont des céphalées, des vertiges, des œdèmes périphériques, des palpitations et des bouffées congestives.
Liste tabulée des effets indésirables
Les réactions indésirables énumérées ci-dessous ont été observées pendant des études cliniques et/ou après commercialisation et sont basées sur des données issues d’essais cliniques et classifiées par classe de système d’organe MedDRA. Les catégories de fréquence sont définies selon la convention suivante : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000) et indéterminée (ne peut être estimée sur la base des données disponibles).
|
Classe de systèmes d’organes |
Fréquence |
|
Affections hématologiques et du système lymphatique |
Fréquence indéterminée : thrombopénie |
|
Affections du système immunitaire |
Fréquence indéterminée : réaction anaphylactique |
|
Affections du système nerveux |
Très fréquent : céphalées |
|
Fréquent : vertiges |
|
|
Affections cardiaques |
Fréquent : œdèmes des membres inférieurs, palpitations |
|
Fréquent : hypotension, tachycardie |
|
|
Fréquence indéterminée : bloc auriculo-ventriculaire, angine de poitrine |
|
|
Affections vasculaires |
Fréquent : hypotension orthostatique |
|
Fréquence indéterminée : bouffées congestives et rougeur de la face (flushing) |
|
|
Affections respiratoires, thoraciques et médiastinales |
Fréquence indéterminée : œdème pulmonaire* |
|
Affections gastro-intestinales |
Fréquent : nausées, vomissements |
|
Fréquence indéterminée : iléus paralytique |
|
|
Affections hépatobiliaires |
Fréquence indéterminée : augmentation des enzymes hépatiques |
|
Affections de la peau et du tissu sous-cutané |
Fréquence indéterminée : érythème, rash cutané |
|
Troubles généraux et anomalies au site d’administration |
Fréquence indéterminée : phlébite |
|
Investigations |
Fréquence indéterminée : augmentation des enzymes hépatiques |
*des cas ont également été signalés lors de l’utilisation comme tocolytique pendant la grossesse (voir rubrique 4.6).
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet : www.signalement-sante.gouv.fr.
Un surdosage avec le chlorhydrate de nicardipine peut potentiellement entraîner les symptômes suivants: hypotension marquée, bradycardie, palpitations, bouffées congestives, somnolence, collapsus, œdèmes périphériques, confusion, troubles de l’élocution et hyperglycémie. Chez l’animal, le surdosage a également entraîné des anomalies réversibles de la fonction hépatique, des nécroses hépatiques focales sporadiques et un bloc progressif de la conduction auriculo-ventriculaire.
Prise en charge
En cas de surdosage, il est recommandé de prendre les mesures de routine, notamment une surveillance des fonctions cardiaque et respiratoire. En plus des mesures générales, les solutions intraveineuses de calcium et les vasopresseurs sont cliniquement indiqués pour les patients exprimant les effets du bloc de l’entrée calcique. L’hypotension grave peut être traitée par une perfusion intraveineuse d’une solution de remplissage et la position allongée avec élévation des jambes.
La nicardipine n’est pas dialysable.
5. PROPRIETES PHARMACOLOGIQUES 
5.1. Propriétés pharmacodynamiques 
Mécanisme d’action
La nicardipine est un inhibiteur des canaux calciques lents de deuxième génération, appartenant au groupe des phényl-dihydropyridines. La nicardipine a une sélectivité plus élevée pour les canaux calciques de type L du muscle lisse vasculaire que pour les cardiomyocytes. Elle inhibe à très faibles concentrations la pénétration intracellulaire du calcium. Son action s’exerce de façon prépondérante au niveau de la musculature lisse artérielle. Ceci se reflète par des changements relativement importants et rapides de la pression artérielle, avec des changements inotropes minimes de la fonction cardiaque (effet baroréflexe).
Effets pharmacodynamiques
Administrée par voie générale, la nicardipine est un vasodilatateur puissant qui diminue les résistances périphériques totales et abaisse la pression artérielle. La fréquence cardiaque est transitoirement augmentée ; le débit cardiaque, du fait de la diminution de la post-charge, s'accroît de manière importante et durable.
Chez l’homme, l’action vasodilatatrice porte aussi bien en administration aiguë qu'en chronique sur les petits et gros troncs artériels, augmentant le débit et améliorant la compliance artérielle. La résistance vasculaire rénale est diminuée.
5.2. Propriétés pharmacocinétiques 
La nicardipine est fortement liée aux protéines plasmatiques, sur une large gamme de concentrations.
Biotransformation
La nicardipine est métabolisée par le cytochrome P450 3A4. Des études chez l’homme en dose unique, ou en administrations répétées 3 fois par jour pendant 3 jours, ont montré que moins de 0,03% de nicardipine inchangée est retrouvée dans l’urine après administration orale ou intraveineuse. Le métabolite prédominant dans l’urine humaine est le glucuronide de la forme hydroxy, formé par clivage oxydatif du groupe N-méthylbenzyle et l’oxydation du cycle pyridine.
Élimination
Dans les 96 heures après administration simultanée d’une dose intraveineuse de nicardipine marquée et d’une dose orale de 30 mg toutes les 8 heures, 49% de la radioactivité a été retrouvée dans l’urine et 43% dans les fèces. Aucun des produits administrés n’a été retrouvé dans l’urine sous forme de nicardipine inchangée. Le profil d’élimination du médicament après une dose intraveineuse comporte trois phases, avec des demi-vies correspondantes : alpha 6,4 min, bêta 1,5 heures, gamma 7,9 heures.
Insuffisance rénale
La pharmacocinétique de la nicardipine administrée par voie intraveineuse a été étudiée chez des sujets atteints d’insuffisance rénale sévère nécessitant une hémodialyse (clairance de la créatinine < 10 mL/min), insuffisance rénale sévère/modérée (clairance de la créatinine 10 - 50 mL/min) et chez les patients avec une clairance de la créatinine > 50 mL/min. A l’état d’équilibre, la Cmax et l’AUC étaient significativement supérieures et la clairance significativement inférieure chez les sujets atteints d’insuffisance rénale sévère/modérée par rapport aux sujets avec clairance de la créatinine >50 mL/min. Il n’y avait pas de différence significative des principaux paramètres pharmacocinétiques entre atteinte sévère de la fonction rénale et fonction rénale normale.
5.3. Données de sécurité préclinique 
Sorbitol (E420), acide citrique monohydraté, citrate de sodium, acide chlorhydrique concentré (pour ajustement du pH), hydroxyde de sodium (pour ajustement du pH), eau pour préparations injectables.
· Ce médicament ne doit pas être mélangé avec d'autres médicaments à l'exception de ceux mentionnés dans la rubrique 6.6.
· Précipitation avec les produits présentant en solution, un pH supérieur à 6 (par exemple: solution bicarbonatée, soluté de Ringer, diazépam, furosémide, méthohexital sodique, thiopental).
· Risque d'absorption de la nicardipine sur les matériaux plastiques des dispositifs de perfusion en présence de solutions salines.
La stabilité physicochimique de la solution non diluée dans une seringue en polypropylène ou de la solution après dilution dans du glucose 5 % à la concentration de 4 mg/50 ml dans une seringue en polypropylène a été démontrée pendant 48 heures à 25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement.
6.4. Précautions particulières de conservation 
A conserver à une température ne dépassant pas 25°C
6.5. Nature et contenu de l'emballage extérieur 
10 ml en ampoule (verre brun). Boîte de 5, 10 et 50.
6.6. Précautions particulières d’élimination et de manipulation 
Ce médicament peut être mélangé avec du glucose 5 %.
7. TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE 
VAULT 14, LEVEL 2
VALLETTA WATERFRONT
FLORIANA, FRN 1914
MALTE
8. NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE 
· 416 170-5 ou 34009 416 170 5 8: 10 ml en ampoule (verre brun). Boîte de 5.
· 416 864-7 ou 34009 416 864 7 4: 10 ml en ampoule (verre brun). Boîte de 10.
· 579 570-2 ou 34009 579 570 2 5: 10 ml en ampoule (verre brun). Boîte de 50.
9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L’AUTORISATION 
[à compléter ultérieurement par le titulaire]
10. DATE DE MISE A JOUR DU TEXTE 
[à compléter ultérieurement par le titulaire]
Sans objet.
12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES 
Liste I
Médicament réservé à l’usage hospitalier et à l’usage en situation d’urgence selon l’article R-5121-96 du code de la santé publique.
ANSM - Mis à jour le : 20/10/2022
NICARDIPINE ARROW 10 mg/10 ml, solution injectable
Chlorhydrate de nicardipine
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin, votre pharmacien ou votre infirmier/ère.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que NICARDIPINE ARROW 10 mg/10 ml, solution injectable et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser NICARDIPINE ARROW 10 mg/10 ml, solution injectable?
3. Comment utiliser NICARDIPINE ARROW 10 mg/10 ml, solution injectable
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver NICARDIPINE ARROW 10 mg/10 ml, solution injectable?
6. Contenu de l’emballage et autres informations.
1. QU’EST-CE QUE NICARDIPINE ARROW 10 mg/10 ml, solution injectable ET DANS QUELS CAS EST-IL UTILISE ? 
NICARDIPINE ARROW est utilisée pour traiter l’hypertension artérielle très sévère. Elle peut également être utilisée pour contrôler l’hypertension artérielle après une opération.
Vous devez vous adresser à votre médecin si vous ne ressentez aucune amélioration ou si vous vous sentez moins bien.
2. QUELLES SONT LES INFORMATIONS A CONNAITRE AVANT D’UTILISER NICARDIPINE ARROW 10 mg/10 ml, solution injectable ? 
N’utilisez jamais NICARDIPINE ARROW 10 mg/10 ml, solution injectable :
· si vous êtes allergique à la nicardipine ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
· si vous souffrez d’une douleur dans la poitrine.
· Si votre hypertension est due au rétrécissement d’une valve cardiaque ou à d’autres anomalies cardiaques.
· Si vous avez une sténose aortique sévère (rétrécissement de l'artère principale partant du cœur).
· Si vous avez eu une crise cardiaque au cours des huit derniers jours.
Avertissements et précautions
Adressez-vous à votre médecin, pharmacien ou votre infirmier/ère avant d’utiliser NICARDIPINE ARROW 10 mg/10 ml, solution injectable.
Votre médecin fera preuve de prudence :
· Si vous souffrez d’insuffisance cardiaque.
· Si vos reins ne fonctionnent pas correctement
· Si vous avez une angine de poitrine.
· Si votre foie ne fonctionne pas correctement, ou si vous avez souffert d’une maladie du foie par le passé.
· Si vous présentez une hypertension intracrânienne.
· Si vous avez récemment eu un accident vasculaire cérébral.
· Si vous prenez des médicaments bêtabloquants.
· Si vous êtes enceinte.
· Si vous êtes âgé(e) de moins de 18 ans.
Si vous présentez ces conditions, votre médecin pourra avoir besoin de vous faire passer des tests supplémentaires ou de modifier la posologie. Si l’une des conditions ci-dessus s’applique à votre cas, ou si vous n’en êtes pas certain(e), parlez-en à votre médecin avant l’administration de NICARDIPINE ARROW.
L’utilisation de ce médicament est déconseillée chez les patients présentant une intolérance au fructose (maladie héréditaire rare).
Enfants et adolescents
Sans objet.
Autres médicaments et NICARDIPINE ARROW 10 mg/10 ml, solution injectable.
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
Cela est nécessaire car NICARDIPINE ARROW peut affecter la façon dont d’autres médicaments agissent. De même, certains autres médicaments peuvent affecter la façon dont NICARDIPINE ARROW agit.
En particulier, informez votre médecin si vous prenez l’un des médicaments suivants :
· Dantrolène (utilisé dans le traitement de la raideur musculaire chronique).
· Bêtabloquants (utilisés dans le traitement de l’hypertension et des affections cardiaques), tels que propranolol, aténolol et métoprolol.
· Médicaments utilisés pour le contrôle des crises convulsives, tels que carbamazépine, phénobarbitone, primidone, fosphénytoïne et phénytoïne.
· Baclofène (utilisé dans le traitement des spasmes musculaires).
· Médicaments utilisés pour le contrôle du système immunitaire de l’organisme, tels que tacrolimus, sirolimus, évérolimus, temsirolimus et ciclosporine.
· Itraconazole, kétoconazole, voriconazole (utilisé dans le traitement de certains types d’infections fongiques).
· Certains médicaments utilisés dans le traitement de certaines maladies virales (bocéprévir, ritonavir, télaprévir)
· Certains antibiotiques (clarithromycine, érythromycine, télithromycine)
· Rifampicine (utilisée dans le traitement de la tuberculose et de certains autres types d’infections).
· Alpha-bloquants (utilisés dans le traitement de l’hypertension ou des problèmes de prostate chez les hommes), tels que alfuzosine, doxazosine, prazosine, silodosine, tamsulosine, térazosine et uradipil.
· Tout autre médicament pour l’hypertension.
· Cimétidine (pour le traitement de l’indigestion ou des ulcères d’estomac).
· Digoxine (utilisée pour des affections cardiaques).
· Amifostine (utilisée contre les effets nocifs de certains traitements anticancéreux).
· Médicaments pour le traitement de la dépression, de l’anxiété ou d’autres problèmes de santé mentale.
· Médicaments analgésiques puissants, comme la morphine ou la codéine.
· Médicaments utilisés dans le traitement de l’inflammation, tels que les stéroïdes et le tétracosactide.
· Injection de magnésium (utilisée dans le traitement de l’hypertension sévère chez la femme enceinte).
· Médicaments utilisés dans le traitement de la leucémie lymphoïde chronique (Idélalisib).
· Médicaments nitrés et apparentés.
· Médicaments à l’origine d’une hypotension orthostatique.
Si vous devez subir une opération, votre anesthésiste devra savoir quels sont les autres médicaments que vous prenez, car certains d’entre eux peuvent affecter la façon dont NICARDIPINE ARROW agit.
NICARDIPINE ARROW 10 mg/10 ml, solution injectable (I.V.) avec des aliments, boissons
Ne buvez pas de jus de pamplemousse et ne mangez pas de pamplemousse lors de la prise de ce médicament car cela peut augmenter les concentrations de nicardipine dans le sang. Grossesse et allaitement
Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament.
Conduite de véhicules et utilisation de machines
Ce médicament peut altérer la capacité de conduire des véhicules ou l'utilisation des machines. Plus particulièrement au début ou en cas de modification du traitement, ainsi qu'en association à l'alcool. NICARDIPINE ARROW 10 mg/10 ml, solution injectable contient du sorbitol
3. COMMENT UTILISER NICARDIPINE ARROW 10 mg/10 ml, solution injectable? 
Ce médicament vous sera administré à l’hôpital.
Votre médecin décidera de la quantité de NICARDIPINE ARROW qui vous sera administrée. Celle-ci dépendra du niveau et de la vitesse auxquels on souhaite diminuer votre tension artérielle.
Le médicament sera injecté lentement dans une veine. Votre tension artérielle sera prise lorsque vous recevrez votre traitement et la posologie sera ajustée pour veiller à ce que votre tension artérielle retourne à des valeurs normales.
NICARDIPINE ARROW vous sera administré par un médecin qui veillera à ce que la dose qui vous est administrée soit adaptée à votre affection. Si vous avez des inquiétudes, parlez-en à votre médecin ou infirmier/ière.
Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin ou pharmacien. Vérifiez auprès de votre médecin ou pharmacien en cas de doute.Si vous avez utilisé plus de NICARDIPINE ARROW 10 mg/10 ml, solution injectable que vous n’auriez dû
Consultez immédiatement votre médecin ou votre pharmacien. Si vous oubliez d’utiliser NICARDIPINE ARROW 10 mg/10 ml, solution injectable
Si vous arrêtez d’utiliser NICARDIPINE ARROW 10 mg/10 ml, solution injectable
Sans objet.
Si vous avez d’autres questions sur l’utilisation de ce médicament, demandez plus d’informations à votre médecin, à votre pharmacien ou à votre infirmier/ère.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ? 
Les maux de tête sont l’effet indésirable le plus fréquent, et peuvent affecter 1 personne sur 10.
Les autres effets indésirables (pouvant affecter jusqu’à 1 personne sur 10) sont :
· Vertiges.
· Jambes ou chevilles gonflées.
· Augmentation de la fréquence cardiaque, battements du cœur perceptibles (palpitations).
· Hypotension, en particulier lors du passage en position debout, cela pouvant entraîner des vertiges, des étourdissements ou une perte de connaissance.
· Sensation de malaise ou vomissements.
Autres effets secondaires (fréquence indéterminée - ne pouvant être estimée sur la base des données disponibles).
· Diminution du nombre de plaquettes dans le sang, ce qui peut accroître le risque de saignement ou d’ecchymose.
· Troubles de la conduction cardiaque se manifestant par une diminution de la fréquence cardiaque pouvant évoluer vers un malaise.
· Fréquence cardiaque basse.
· Douleur thoracique.
· Problèmes cardiaques entraînant une accumulation de liquide dans les poumons et un essoufflement.
· Douleur abdominale.
· Rougeur de la peau.
· Inflammation de la veine dans laquelle le médicament a été administré.
· Modification des résultats d’analyses de sang portant sur le fonctionnement de votre foie.
· Réaction allergique généralisée.
· Eruption cutanée (rash).
· Rougeurs et sensations de chaleur au niveau du visage.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin, votre pharmacien ou à votre infirmier/ère. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance - Site internet: www.signalement-sante.gouv.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER NICARDIPINE ARROW 10 mg/10 ml, solution injectable ? 
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur la boîte après « EXP ». La date de péremption fait référence au dernier jour de ce mois.
Avant ouverture : A conserver à une température ne dépassant pas 25°C.
Après ouverture : La stabilité physicochimique de la solution non diluée dans une seringue en polypropylène ou de la solution après dilution dans du glucose 5 % à la concentration de 4 mg/50 ml dans une seringue en polypropylène a été démontrée pendant 48 heures à 25°C. Toutefois du point de vue microbiologique, le produit doit être utilisé immédiatement.
Ne jetez aucun médicament au tout-à-l’égout ou avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS 
Ce que contient NICARDIPINE ARROW 10 mg/10 ml, solution injectable 
· La substance active est:
Chlorhydrate de nicardipine.............................................................................................. 10 mg
Pour une ampoule de 10 ml.
1 ml de solution injectable contient 1 mg de chlorhydrate de nicardipine.
· Les autres composants excipients sont :
Sorbitol (E420), acide citrique monohydraté, citrate de sodium, acide chlorhydrique concentré, hydroxyde de sodium, eau pour préparations injectables.
Qu’est-ce que NICARDIPINE ARROW 10 mg/10 ml, solution injectable et contenu de l’emballage extérieur 
Ce médicament se présente sous forme de solution injectable en ampoule de 10 ml. La solution est limpide.
Boîte de 5,10 et 50 ampoules.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché 
VAULT 14, LEVEL 2
VALLETTA WATERFRONT
FLORIANA, FRN 1914
MALTE
Exploitant de l’autorisation de mise sur le marché 
26, AVENUE TONY GARNIER
69007 LYON
1 RUE COMTE DE SINARD
26250 LIVRON SUR DROME
OU
ARROW GENERIQUES
26, AVENUE TONY GARNIER
69007 LYON
Noms du médicament dans les Etats membres de l'Espace Economique Européen 
Sans objet.
La dernière date à laquelle cette notice a été révisée est : 
[à compléter ultérieurement par le titulaire]
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).
Les informations suivantes sont destinées exclusivement aux professionnels de santé:
Ouverture de l'ampoule autocassable :
1. Tenir l'ampoule en orientant le point de couleur vers le haut. Si du liquide se trouve dans la partie haute de l'ampoule, tapoter pour faire descendre dans le corps de l'ampoule.
2. Puis saisir l'extrémité de l'ampoule (au-dessus du point) et exercer une pression pour casser l'ampoule comme indiqué sur le dessin.
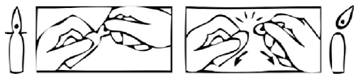
Incompatibilités majeures :
Il existe un risque de précipitation avec les produits présentant en solution un pH supérieur à 6 (par exemple : solution bicarbonatée, soluté de Ringer, diazépam, furosémide, méthohexidal sodique, thiopental).
Il existe un risque d’adsorption de la nicardipine sur les matériaux plastiques des dispositifs de perfusion en présence de solutions salines.




